Undersøgelse viser, hvordan bioaktivt stof hæmmer vigtig receptor
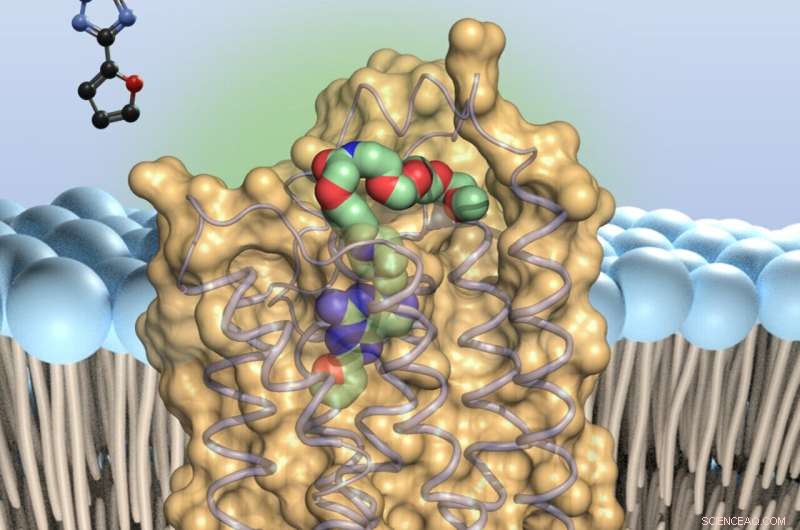
Adenosinantagonisten (farvet) - binder sig til bittesmå antenner på overfladen af immuncellerne, adenosinreceptorerne af type 2A. Dette bremser immunstyrkerne. Kredit:Universitetet i Bonn
A2A-receptoren regulerer, hvor kraftigt det medfødte immunsystem angriber syge celler. Forskere ved universitetet i Bonn har nu for første gang kunnet vise, hvordan en vigtig inhibitor binder sig til receptoren. I fremtiden vil resultaterne lette den målrettede søgning efter molekyler, der giver det medfødte immunsystem mere slagkraft. Disse kan for eksempel bruges i kampen mod kræft, men også mod hjernesygdomme som Alzheimers eller Parkinsons sygdom. Den endelige version af undersøgelsen er blevet offentliggjort i tidsskriftet Angewandte Chemie International Edition .
Enhver, der nyder at læse thrillers, ved:Inden tyve bryder ind i et palæ, kaster de gerne en saftig kotelet over hegnet, hvori de har gemt et par sovepiller. Da vagthundene kommer ned til deres anden middag, bukker de under for dyb dvale kort efter. Juvelerne hos fruen i huset skifter hænder meget mere uforstyrret efter det.
Tumorceller forløber ofte på en meget lignende måde:De udstøder sovepiller, der lammer immunforsvaret. Mere specifikt omgiver de sig med en sky af adenosin, en vigtig endogen budbringer. På den måde deaktiverer de kroppens egne "dræberceller", som ellers ville få kræftcellerne til at dø.
Det skyldes, at adenosinmolekylerne binder sig til bittesmå antenner på overfladen af immuncellerne, A2A-receptorerne (forkortelsen står for "type 2A adenosinreceptorer"). Dette slår så at sige de defensive tropper ud. Forskere over hele kloden leder derfor efter molekyler, der kan blokere A2A-receptoren og forhindre den lammende virkning af adenosin.
Bombardement med røntgenstråler
"Vores undersøgelse burde gøre denne søgning meget lettere," forklarer prof. Dr. Christa Müller fra det farmaceutiske institut ved universitetet i Bonn. "Vi har tilføjet nye varianter af en kendt hæmmer, et stof kaldet præladenant, til A2A-receptoren. Derefter har vi skabt krystaller ud fra receptor-hæmmer-komplekserne - det er første gang i verden, at det er opnået med præladenant-lignende stoffer. "
Krystallisation gjorde det muligt at belyse kompleksets struktur. "For at gøre dette bombarderer vi forbindelsen med røntgenstråler," forklarer Tobias Claff, der udførte hovedparten af eksperimenterne. "Krystallen diffrakterer strålerne. Måden den gør dette på giver os mulighed for at udlede kompleksets rumlige struktur – helt ned til arrangementet af individuelle atomer og deres interaktioner."
På denne måde kunne forskerne vise, til hvilke punkter af A2A-receptoren præladenant binder. Med denne viden er det nu muligt specifikt at modificere inhibitoren for at give den bedre egenskaber. Udover at have den stærkest mulige effekt, bør lægemidler fx ikke nedbrydes for hurtigt. De skal også være i stand til at nå det sted, hvor de skal udføre deres arbejde - i dette tilfælde hjernen. "Vores undersøgelse vil gøre det meget nemmere at optimere stoffet," siger Claff med optimisme.
A2A tilhører en gruppe af receptorer, der regulerer nøglefunktioner i kroppen. De spænder over cellernes membran. Den del af dem, der sidder på ydersiden af membranen, fungerer som en sensor, der modtager molekylære signaler som en antenne. Når den gør det, udløser den specifikke reaktioner med sin del, der rager ind i cellen. Dette aktiverer så f.eks. visse gener.
Farvestof bundet til det hæmmende molekyle
"Disse receptorer er uhyre vigtige på grund af deres centrale position," siger Christa Müller, som også er medlem af de tværfaglige forskningsområder (TRA) "Building Blocks of Matter" og "Life and Health." "Mange af dem er dog desværre relativt ustabile. Dette er ugunstigt for røntgenstrukturanalyser - krystallisering tager dage, nogle gange endda uger." Forskerne modificerede derfor specifikt A2A-receptoren på et enkelt punkt, hvilket gjorde den betydeligt mere stabil.
Derudover lykkedes det at fastgøre et farvestof til præladenanten med en slags molekylær streng. "Dette giver os mulighed for at kontrollere, hvor i vævet præladenant binder sig til A2A-receptoren," siger Müller. Samtidig sikrer længden og fleksibiliteten af nanostrengen, at inhibitoren ikke hindres i at binde sig til receptoren.
Begge fremskridt kunne også tjene som modeller for arbejde med andre receptorer, der tilhører samme gruppe. "De metoder, vi har udviklet i Bonn i de senere år, vil give os mulighed for at belyse strukturen af sådanne og andre cellemembranproteiner i fremtiden," er farmaceuten overbevist. "Der er ikke mange forskningsfaciliteter, der kan udføre denne form for strukturelle analyser af ekstremt komplekse molekyler." + Udforsk yderligere
Aktivering af opioidreceptor afdækket
 Varme artikler
Varme artikler
-
 Ny målrettet modifikationsstrategi forbedrer selektiviteten af polyamid -nanofiltreringsmembranerDiagram over målrettet ændring af polyamid nanofiltreringsmembran Kredit:Wang Jingyu For nylig, en forskergruppe ledet af Prof. Undersøgelsen blev offentliggjort i Journal of Membrane Science de
Ny målrettet modifikationsstrategi forbedrer selektiviteten af polyamid -nanofiltreringsmembranerDiagram over målrettet ændring af polyamid nanofiltreringsmembran Kredit:Wang Jingyu For nylig, en forskergruppe ledet af Prof. Undersøgelsen blev offentliggjort i Journal of Membrane Science de -
 Forskere opdager, at molekyler spin flip fra magnetiske til ikke-magnetiske former dynamiskKredit:University of Missouri-Columbia En uventet opdagelse i professor Arthur Suits kemilaboratorium kunne få konsekvenser for fremstilling af mere effektive solceller og forbedring af fotodynami
Forskere opdager, at molekyler spin flip fra magnetiske til ikke-magnetiske former dynamiskKredit:University of Missouri-Columbia En uventet opdagelse i professor Arthur Suits kemilaboratorium kunne få konsekvenser for fremstilling af mere effektive solceller og forbedring af fotodynami -
 Vedvarende opløsningsmidler afledt af lignin sænker spild i biobrændstofproduktionBioraffinaderi-konceptet, der bruger fornybare dybe eutektiske opløsningsmidler (DES) afledt af ligninråvarer, er vist her. Kredit:US Department of Energy Et bioraffinaderi med lukket kredsløb kan
Vedvarende opløsningsmidler afledt af lignin sænker spild i biobrændstofproduktionBioraffinaderi-konceptet, der bruger fornybare dybe eutektiske opløsningsmidler (DES) afledt af ligninråvarer, er vist her. Kredit:US Department of Energy Et bioraffinaderi med lukket kredsløb kan -
 Molekyle fra naturen giver fuldt genanvendelige polymererForskere fra University of Groningen (Holland) og East China University of Science and Technology (ECUST) i Shanghai producerede forskellige polymerer ud fra liponsyre, et naturligt molekyle. Disse po
Molekyle fra naturen giver fuldt genanvendelige polymererForskere fra University of Groningen (Holland) og East China University of Science and Technology (ECUST) i Shanghai producerede forskellige polymerer ud fra liponsyre, et naturligt molekyle. Disse po
- Nylige fremskridt og ny indsigt i kvante billedbehandling
- Ny selvsamlende metode til fremstilling af grafen nanobånd
- 1986 Alaska UFO
- Ny metode til undersøgelse af individuelle defekter i transistorer
- Kan et multivers være gæstfrit til livet?
- En ny enhed med huske- og glemmefunktioner som den menneskelige hjerne er rapporteret


