Forskere udforsker skabelsen af kunstige organeller
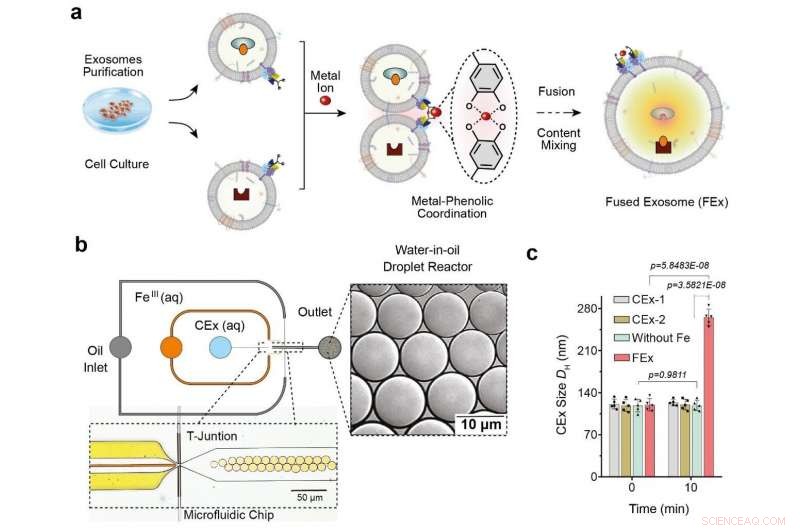
(a) Fe3+ ion udløser membranfusion i exosomer skræddersyet med catechol (CEx). Dannelsen af et metal-catechol kompleks bringer exosomer i umiddelbar nærhed og muliggør fusion. Forskellige reaktanter i hvert exosom indkapsles derefter sammen, fremmer blanding og udløser reaktioner inde i de fusionerede exosomer (FEx). (b) Den mikrofluidiske anordning designet til at generere vand-i-olie dråbereaktorer ved det strømningsfokuserende kryds. De to vandige faser (CEx og metalsalt) mødes og leveres til oliestrømmen (1 % overfladeaktivt stof PFPE-PEG i FC-40) for at bryde væsken i dråber. (c) Gennemsnitlig størrelse af ufusionerede exosomer (CEx-1:121 ± 8 nm, CEx-2:123 ± 5 nm) og fusionerede exosomer (FEx:265 ± 14 nm). Kredit:Institut for Grundvidenskab
Celler har små rum kendt som organeller, der udfører komplekse biokemiske reaktioner. Disse rum har flere enzymer, der arbejder sammen om at udføre vigtige cellulære funktioner. Forskere ved Center for Blødt og Levende Stof ved Institut for Grundvidenskab (IBS, Sydkorea) har med succes efterlignet disse rumlige rum i nanoskala for at skabe "kunstige mitokondrier." Undersøgelsen er publiceret i Naturkatalyse som forsideartikel. Forskerne slår fast, at teknologien kan bruges til at konstruere kunstige organeller, der kan levere ATP eller andre nyttige molekyler til celler i beskadiget eller sygt væv.
Dette blev opnået gennem omprogrammering af exosomer, som er små vesikler (diameter ~120 nm), som celler bruger til intercellulær signalering. Forskerne udførte eksperimenterne ved hjælp af mikrofluidiske dråbereaktorer, som genererede små dråber, der havde samme størrelse som typiske celler. (diameter ~10 μm) Forskerne havde først til formål at lette kontrolleret fusion af disse exosomer i dråberne og samtidig forhindre uønskede fusioner.
De opnåede dette ved at skræddersy exosomoverfladerne med molekyler kaldet catechol, som er et chelateringsmiddel, der danner komplekser med metalioner. Dette blev igen gjort ved at binde katekolen til antistoffer, der målretter mod specifikke cellemarkører, såsom CD9. Katekols kompleksdannende egenskab gør det muligt for dem at drive fusioner mellem exosomer, når de blandes med metalioner såsom Fe 3+ . Membranfusionen opstår, når katekolerne på overfladerne binder til jernet og bringer vesiklerne tæt på hinanden.
Forskere testede først effektiviteten af dette system ved at indlæse en type exosomer med calcein-Co 2+ og en anden med EDTA. Når de to vesikler smelter sammen og indholdet blandes, EDTA griber Co 2+ væk fra calcein, som så tillader sidstnævnte at fluorescere. Holdet indså, at de havde succes med påvisningen af fluorescenssignalet, og fusionen blev yderligere bekræftet ved fordobling af den målte exosomdiameter.
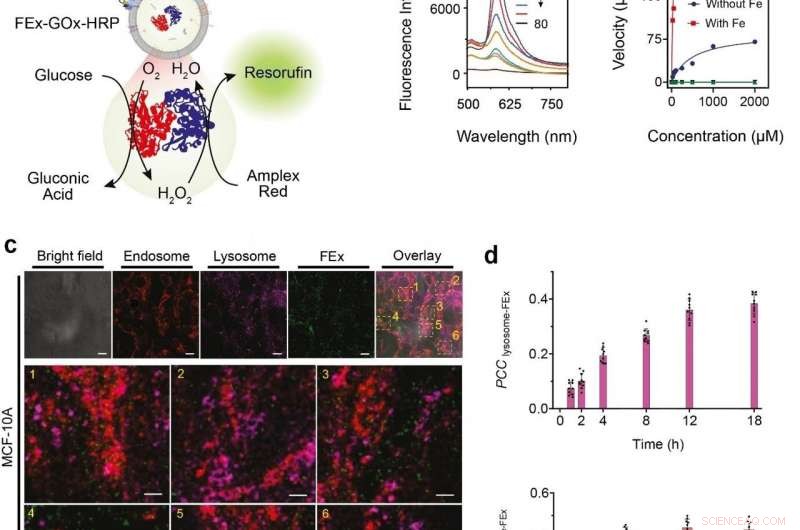
(a) Skematisk repræsentation af et to-enzym GOx/HRP CEx, der fusionerer til FEx. Den katalytiske reaktion blev initieret ved tilsætning af glucose, generere H2O2 ved aerob oxidation, som derefter blev brugt til at oxidere Amplex Red for at generere resorufin. (b) Repræsentative fluorescensspektre af resorufin genereret ved biokatalyse i fusionerede exosomer (FEx-GOx-HRP) på forskellige tidspunkter. Reaktionshastighed for nanoreaktoren vs glukosekoncentration for at beregne kinetiske konstanter ved at tilpasse Michaelis-Menten-ligningen. (c) Stabilitet og integritet af FEx-GOx-HRP efter cellulær integration efter 48 timer. Endosomer (EEA1, røde) lysosomer (LAMP1, magenta), og FEx (grøn) vises. (d) Plot af Pearson korrelationskoefficient (PCCLysosome-FEx) værdier over tid for magenta (lysosom) og grøn (FEx) fluorescens, og for rød (Endosom) og grøn (FEx) fluorescens. Kredit:Institut for Grundvidenskab
Disse tilpassede exosomer blev derefter præloadet med forskellige reaktanter og enzymer, som gjorde dem til biomimetiske nanofabrikker. Dette giver dem mulighed for at producere biomolekyler af høj værdi ved at udføre ønskede biokatalytiske transformationer på en rumlig begrænset måde, hvilket ikke er muligt ved brug af konventionelle laboratoriereagensglas. Holdet demonstrerede denne multienzym biokatalytiske kaskadefunktion ved at indkapsle glucoseoxidase (GOx) og peberrodsperoxidase (HRP) inde i exosomer. GOx omdanner først glucose til gluconsyre og hydrogenperoxid. HRP'en bruger igen det hydrogenperoxid, der dannes i den første reaktion, til at oxidere Amplex Red til et fluorescerende produkt, resorufin. Forskerne var endda i stand til at tage et skridt videre ved at tilføje et tredje enzym, galactosidase som omdanner laktose til glucose, ind i blandingen.
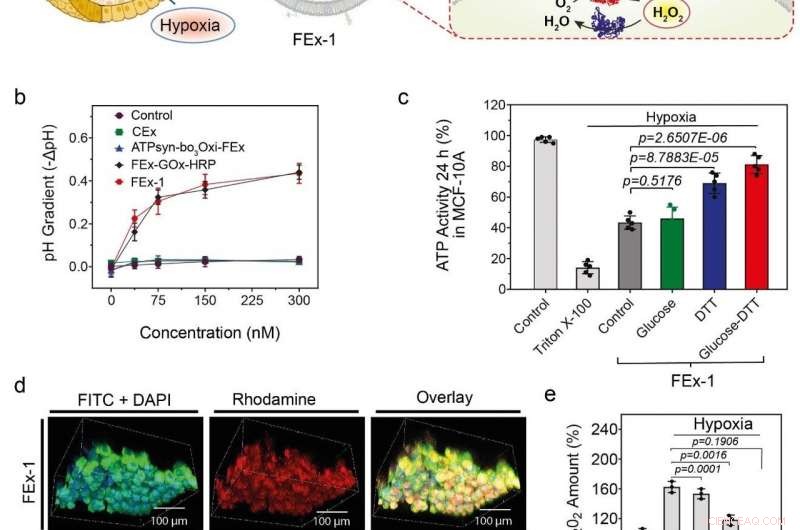
(a) Samling af kunstige organeller til energiproduktion. ATP-syntase blev rekonstitueret til CEx-GOx, og bo3-oxidase blev rekonstitueret til CEx-HRP. De to CEx var smeltet sammen og var i stand til at trænge dybt ind i sfæroider. (b) Fald i pH (-ΔpH) vs. glucosekoncentrationer for forskellige exosomer. Sammensmeltede exosomer viser en større grad af pH-fald. (c) Ændringer i ATP-produktion efter FEx-1-optagelse under forskellige forhold. (d) Kunstige organeller var i stand til at trænge dybt ind i sfæroiden. Den øverste række viser FEx-1 (mærket rød med rhodamin B), mens den nederste række viser frit HRP-enzym inde i sfæroider. (e) Overordnede ROS-niveauer faldt ved at udsætte FEx-1 under glucose og DTT. Kredit:Institut for Grundvidenskab
Næste, forskerne ville vide præcis, hvor godt disse minireaktorer kan optages og internaliseres af cellerne. Cellerne afledt af humant brystvæv blev fodret med fusionerede exosom nanoreaktorer, og deres internalisering i løbet af de næste 48 timer blev observeret ved hjælp af forskellige markører og et konfokalt laserscanningsmikroskop (CLSM). Det blev fundet, at celler var i stand til at optage disse tilpassede exosomer primært gennem endocytose, sammen med flere andre mekanismer. De testede yderligere GOx-HRP to enzymsystemet i cellerne, og det blev fundet, at de fusionerede exosomer var i stand til med succes at fremstille fluorescerende produkter, selv mens de var inde i cellerne.
Bevæbnet med denne viden, holdet søgte at skabe funktionelle kunstige mitokondrier, der er i stand til at producere energi inde i cellerne. For at opnå dette, ATP-syntase og bo 3 oxidase blev rekonstitueret til de tidligere exosomer indeholdende GOx og HRP, henholdsvis. Disse exosomer blev igen smeltet sammen for at skabe nanoreaktorer, der kan producere ATP ved hjælp af glucose og dithiothreitol (DTT). Det blev fundet, at de fusionerede exosomer var i stand til at trænge dybt ind i kernedelen af et fast sfæroidvæv og producere ATP i dets hypoxiske miljø. Aktiviteterne af disse simple organeller blev ledsaget af markant reduktion af generering af reaktive oxygenarter (ROS). I modsætning, frie enzymer var ude af stand til at trænge ind i disse tætpakkede sfæroider af celler.
"Taget sammen, vores resultater fremhæver potentialet af disse exosomer som nanoreaktorer til at regulere den metaboliske aktivitet af celler inde i sfæroider, og til at dæmpe celleskader på grund af hypoxi, " bemærker CHO Yoon-Kyoung, den tilsvarende forfatter til undersøgelsen. Det er håbet, at yderligere forskning i sådanne kunstige organeller vil præsentere et nyt paradigme inden for forskellige områder såsom sygdomsdiagnose og behandling, bioteknologi, medicin, og miljøet.
 Varme artikler
Varme artikler
-
 Grafen dobbeltlag giver effektiv transport og kontrol af spinsIllustration af anisotrop spintransport i en tolags grafenflage mellem injektor- og detektorelektroder. Ud-af-plan-spindene overføres godt, mens in-plane-spindene henfalder hurtigt. Kredit:Talieh Ghia
Grafen dobbeltlag giver effektiv transport og kontrol af spinsIllustration af anisotrop spintransport i en tolags grafenflage mellem injektor- og detektorelektroder. Ud-af-plan-spindene overføres godt, mens in-plane-spindene henfalder hurtigt. Kredit:Talieh Ghia -
 Nanoskala optisk pulsbegrænser lettet af ildfaste metalliske kvantebrøndeSammenligning af den traditionelle bulktransmissionstilstand og de foreslåede nanoskala refleksionstilstands pulsbegrænsere. (A og B) Konventionelle konfigurationer (ikke i skala) udbredt til optisk b
Nanoskala optisk pulsbegrænser lettet af ildfaste metalliske kvantebrøndeSammenligning af den traditionelle bulktransmissionstilstand og de foreslåede nanoskala refleksionstilstands pulsbegrænsere. (A og B) Konventionelle konfigurationer (ikke i skala) udbredt til optisk b -
 Forskere opdager spinprecession i silicium nanotrådeFalsk farve atomic force mikroskopi billede af en silicium nanotråd med de fire kontakter brugt i spin målingerne. De ferromagnetiske metal-/grafentunnelbarrierekontakter, der bruges til at injicere o
Forskere opdager spinprecession i silicium nanotrådeFalsk farve atomic force mikroskopi billede af en silicium nanotråd med de fire kontakter brugt i spin målingerne. De ferromagnetiske metal-/grafentunnelbarrierekontakter, der bruges til at injicere o -
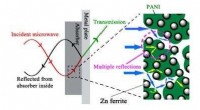 Komposit reducerer betydeligt elektromagnetisk forureningEt skematisk diagram over faseannullering og mikrobølgedæmpningsproces. Den luftige struktur af PANI/Fe ferritkomposit kan i høj grad øge transmissionsvejen for mikrobølger, og de mange refleksioner k
Komposit reducerer betydeligt elektromagnetisk forureningEt skematisk diagram over faseannullering og mikrobølgedæmpningsproces. Den luftige struktur af PANI/Fe ferritkomposit kan i høj grad øge transmissionsvejen for mikrobølger, og de mange refleksioner k
- Kemisk trykindstilling magnetiske egenskaber
- Undersøgelse afslører ny vej til hurtig, effektiv fjernelse af mikroforurenende stoffer i vand
- Farvestoffer og vira skaber nyt kompositmateriale til fotooxidationsreaktioner
- Modellering af mikrosvømmere til medicinafgivelse
- Brug af dyb læring til at lokalisere menneskelige øjne i billeder
- Undersøgelse demonstrerer spektrografinstrumentets evne til at kortlægge månesammensætningen


