Projekter om kemisk binding
Kemiske bindinger holder sammen atomer i forbindelser. Der er to slags kemiske bindinger: kovalente og ioniske bindinger. Kovalente bindinger dannes, når to atomer deler elektroner for at fylde deres yderste valenseskaller. Joniske bindinger dannes, når et atom stjæler elektronerne fra et andet atom, hvilket skaber positive og negative ioner, der binder de to atomer sammen. Kemiske bindingsprojekter kan hjælpe eleverne med at forstå disse vanskelige og uklare begreber.
Elementkort
Opret elementskort med forskellige elementer, der vil skabe kovalente og ioniske bindinger. Alle elementer skal have deres ydre valence elektronskaller vist. En almindelig forbindelse, som har en kovalent binding, er natrium (Na) og chlor (Cl). Natrium har en valenceelektron, og chlor har syv. Ved at dele natriums elektron, kan begge elementer have en komplet ydre skal. En fælles ionbinding er hydrogen (H) og chlor. Hydrogen har en ydre valenselektron, ligesom natrium; hydrogen har dog kun en elektron. Chlor tager brintens elektron. Det deler ikke. Gentag med andre kort, skaber forskellige kovalente og ioniske bindinger.
Varmtestning
Kovalente og ioniske bindinger har forskellige bindingsstyrker. Tilføjelse af energi - varme i de fleste tilfælde - viser de forskelle inden for få minutter. Tag en kendt kovalent bundet forbindelse og opvarm den. Forbindelsen skal smelte efter kun få minutter. Giv en ionisk forbindelse og opvarm den. Jonbindingen bør ikke brydes under den varme, der er givet i en laboratorieindstilling.
Opløsningstest
En anden forskel mellem kovalente og ioniske bindinger er deres evne til at opløse. Brug både vand og ethanol. Opløs opløsninger i begge væsker. Både kovalente og ioniske forbindelser opløses i vand. I ethanol opløses kun kovalent bundne forbindelser. Ioniske forbindelser opløses ikke i ethanol.
Ledning af elektricitet
Når forbindelserne er opløst i vand, kan de testes for at se om de formidler elektricitet. Kovalente obligationer vil ikke formidle elektricitet. Løste ioniske forbindelser vil formidle elektricitet.
Sidste artikelHvad er natriummagnesiumsilikat?
Næste artikelSådan beregnes osmolarity
 Varme artikler
Varme artikler
-
 Fire karakteristika ved kulstofKulstof repræsenterer et af de mest rigelige kemiske elementer på Jorden og falder kun ilt efter dens masse. Livet på Jorden skylder eksistens til kulstof, da det er det kemiske grundlag for alle leve
Fire karakteristika ved kulstofKulstof repræsenterer et af de mest rigelige kemiske elementer på Jorden og falder kun ilt efter dens masse. Livet på Jorden skylder eksistens til kulstof, da det er det kemiske grundlag for alle leve -
 Alkaline Vs. BasicFolk bruger ofte udtrykket alkalisk til basale løsninger, men deres betydning er ikke den samme. Alle alkaliske opløsninger er basale, men ikke alle baser er basiske. Det er almindeligt at henvise til
Alkaline Vs. BasicFolk bruger ofte udtrykket alkalisk til basale løsninger, men deres betydning er ikke den samme. Alle alkaliske opløsninger er basale, men ikke alle baser er basiske. Det er almindeligt at henvise til -
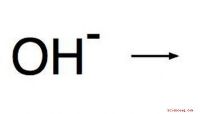 Hvad er alkalisk pH?Med hensyn til det kemiske pH-begreb er alkalisk en anden betegnelse for basisk. Disse to udtryk kan udskiftes. PH-skalaen blev udviklet til at give en numerisk værdi, der svarer til, hvor surt ell
Hvad er alkalisk pH?Med hensyn til det kemiske pH-begreb er alkalisk en anden betegnelse for basisk. Disse to udtryk kan udskiftes. PH-skalaen blev udviklet til at give en numerisk værdi, der svarer til, hvor surt ell -
 Hvilke brød formes hurtigere?De to mest forbrugte brødtyper i Amerika er hvide og multigrain. Nogle familier kan vælge at bage deres eget brød, andre foretrækker måske at købe økologisk brød, men hver familie ved, at hvis de ikke
Hvilke brød formes hurtigere?De to mest forbrugte brødtyper i Amerika er hvide og multigrain. Nogle familier kan vælge at bage deres eget brød, andre foretrækker måske at købe økologisk brød, men hver familie ved, at hvis de ikke


