Sådan beregnes mætningstryk
I et lukket system med væske og damp fortsætter fordampningen, indtil så mange molekyler vender tilbage til væsken som flugt fra den. På dette tidspunkt betragtes dampen i systemet som mættet, fordi det ikke kan absorbere flere molekyler fra væsken. Mætningstryk måler trykket af dampen på det tidspunkt, at fordampning ikke kan øge antallet af molekyler i dampen. Mætningstryk stiger, da temperaturen stiger, da flere molekyler undgår væsken. Kogning sker, når mætningstrykket er lig med eller større end atmosfæretrykket.
Tag temperaturen på det system, som du vil bestemme mætningstryk på. Optag temperaturen i grader Celsius. Tilføj 273 til graderne Celsius for at konvertere temperaturen til Kelvins.
Beregn mætningstryk ved hjælp af Clausius-Clapeyron ligningen. Ifølge ligningen er den naturlige logaritme af mætningstryk divideret med 6,11 lig med produktet af resultatet af at dividere den latente varmetemperatur af gaskonstanten for våd luft multipliceret med forskellen mellem en divideret med temperaturen i Kelvins subtraheret fra en opdelt ved 273.
Fordel 2.453 × 10 ^ 6 J /kg - den latente varmefordamning - ved 461 J /kg - gaskonstanten for våd luft. Multiplicer resultatet, 5,321.0412, ved forskellen mellem en divideret med temperaturen i Kelvins subtraheret fra en divideret med 273.
Løs den naturlige log ved at hæve begge sider af ligningen som beføjelser for e. Den naturlige logaritme af mætningstryk divideret med 6.11 hævet som en kraft e er lig med mætningstrykket divideret med 6.11. Beregn e - en konstant, der svarer til 2,71828183 - hævet til produktets kraft fra det forudgående trin. Multiplicer værdien af hævet e ved 6.11 for at løse for mætningstrykket.
Sidste artikelSådan fortæller du, hvis det er fugtigt uden et hygrometer?
Næste artikelSådan læses et tryk temperatur diagram
 Varme artikler
Varme artikler
-
 Sådan beregnes et koordinationsnummerI fast stof danner atomer og molekyler en række geometriske strukturer afhængigt af den måde, de kombinerer. I hver struktur deler et centralt atom elektroner med andre atomer eller ioniske molekyler,
Sådan beregnes et koordinationsnummerI fast stof danner atomer og molekyler en række geometriske strukturer afhængigt af den måde, de kombinerer. I hver struktur deler et centralt atom elektroner med andre atomer eller ioniske molekyler, -
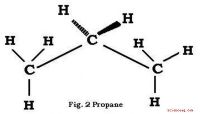 Kemisk formel til propanPropan er en gas afledt af fossilt brændsel og anvendes til madlavning og opvarmning. Analysen viser, at den er lavet helt af kulstof og hydrogen; dens basiske formel er C3H8. Formula Refinement C
Kemisk formel til propanPropan er en gas afledt af fossilt brændsel og anvendes til madlavning og opvarmning. Analysen viser, at den er lavet helt af kulstof og hydrogen; dens basiske formel er C3H8. Formula Refinement C -
 Forskellen mellem relativ atommasse og gennemsnitlig atommasseAtomer har flere forskellige komponenter. I atomens kerne eller kerne er der to typer partikler, protoner og neutroner. Protonerne bestemmer, hvilket element atomet er, og atomets egenskaber. Neutrone
Forskellen mellem relativ atommasse og gennemsnitlig atommasseAtomer har flere forskellige komponenter. I atomens kerne eller kerne er der to typer partikler, protoner og neutroner. Protonerne bestemmer, hvilket element atomet er, og atomets egenskaber. Neutrone -
 Sådan konverteres Joule til MolOmdannelsen af joules (j) til mol (mol) beregnes almindeligvis ved måling af energiforandringer under kemiske reaktioner. A joule is a measure of energy;, 3, [[Hvis en kemisk reaktion producer
Sådan konverteres Joule til MolOmdannelsen af joules (j) til mol (mol) beregnes almindeligvis ved måling af energiforandringer under kemiske reaktioner. A joule is a measure of energy;, 3, [[Hvis en kemisk reaktion producer


