Sådan beregnes en fraktion Covalent
I kemi danner metaller og nonmetaller ionbindinger, og to eller flere nonmetaller danner kovalente bindinger. Disse to bindetyper repræsenterer fundamentalt forskellige atomiske interaktioner: Kovalente bindinger indebærer deling af elektroner mellem atomer, hvorimod ioniske bindinger skyldes atomer, der besidder modsatte ladninger. Sandheden er imidlertid mere kompliceret, fordi få bindinger udviser rent ioniske eller rent kovalente egenskaber. Det vil sige, at bindinger har tendens til at indeholde både ionisk og kovalent karakter. Linus Pauling udledte en ligning til at beskrive en fraktioneret kovalent karakter af en binding baseret på hvert atoms elektronegativitet eller atomets evne til at tiltrække elektroner til sig selv.
Bestem de Pauling-elektronegativiteter af de to elementer, der er involveret i bindingen . Talrige trykte og online referencer giver disse oplysninger (se Ressourcer). For en binding mellem silicium og ilt for eksempel ville elektronegativitetsværdierne være 1,8 for silicium og 3,5 for ilt.
Subtrahere den mindre elektronegativitetsværdi fra den større værdi for at bestemme forskellen i elektrongativitet, X. Fortsættelse af Eksempel fra trin 1 er elektronegativitetsforskellen X = (3,5 - 1,8) = 1,7.
Erstatt værdien af X fra trin 2 i den fraktionskovalente ligning: FC = exp (-0,25 * X ^ 2 ). I eksemplet fremlagt i trin 1 og 2, FC = exp (-0,25 * 1,7 ^ 2) = exp (-0,25 * 2,9) = exp (-0,72) = 0,49.
Tip
Notation exp (x) er den matematiske notation for "e til kraften af x", hvor e er den naturlige logaritme basis, 2.718. Bemærk også, at notationen x ^ 2 angiver "x kvadreret" eller "x til kraften af 2."
Husk altid at følge den videnskabelige rækkefølge af operationer, når der udføres beregninger: Udfør operationer inden for parentes først, og beregne eksponenter før udførelse af multiplikation eller division.
Sidste artikelHvad er Molaritet & Hvordan beregnes det?
Næste artikelSådan beregnes damptryk
 Varme artikler
Varme artikler
-
 Sådan beregnes radius for et AtomAtomets radius beskrives som afstanden fra dens kerne til dets yderste elektroner. Selvom det er umuligt at vide den nøjagtige placering af disse elektroner, kan en meget tæt tilnærmelse af radius for
Sådan beregnes radius for et AtomAtomets radius beskrives som afstanden fra dens kerne til dets yderste elektroner. Selvom det er umuligt at vide den nøjagtige placering af disse elektroner, kan en meget tæt tilnærmelse af radius for -
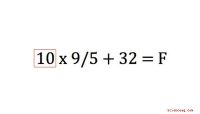 Sådan konverteres Celsius til FahrenheitTrods den metriske konverteringslov fra 1975 forbliver USA et af de få lande, der stadig bruger Fahrenheit-temperaturskalaen. Forskere overalt, herunder i USA, arbejder dog med Celsius temperatur skal
Sådan konverteres Celsius til FahrenheitTrods den metriske konverteringslov fra 1975 forbliver USA et af de få lande, der stadig bruger Fahrenheit-temperaturskalaen. Forskere overalt, herunder i USA, arbejder dog med Celsius temperatur skal -
 Hvad er en syntesereaktion?Spiste du en syntesereaktion til morgenmaden? Det er meget sandsynligt, hvis du indtager taurin, som er resultatet af en organisk syntesereaktion og ofte findes i mælk og æg. I kemi er en syntesere
Hvad er en syntesereaktion?Spiste du en syntesereaktion til morgenmaden? Det er meget sandsynligt, hvis du indtager taurin, som er resultatet af en organisk syntesereaktion og ofte findes i mælk og æg. I kemi er en syntesere -
 Hvordan man laver natriumcarbonatopløsningAt lave natriumcarbonat Du kan selv lave natriumcarbonat til disse løsninger ved at opvarme natriumbicarbonat eller husholdningsbagepulver. Når du opvarmer den til over 80 grader Celsius (176 grader
Hvordan man laver natriumcarbonatopløsningAt lave natriumcarbonat Du kan selv lave natriumcarbonat til disse løsninger ved at opvarme natriumbicarbonat eller husholdningsbagepulver. Når du opvarmer den til over 80 grader Celsius (176 grader


