Oligourea foldamerer efterligner peptider alfa-helices og binder effektivt til lægemiddelmål
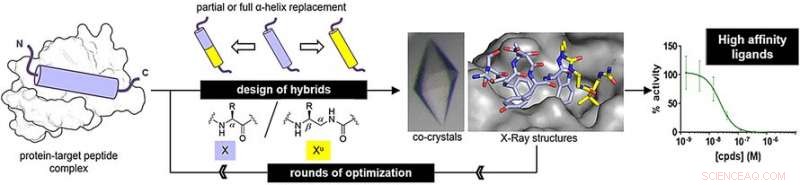
Kredit:Wiley
Nogle nyttige lægemidler består af peptider, der virker på deres proteinmål. For at gøre dem mere effektive og stabile, forskere har fundet en måde at erstatte afgørende segmenter af peptiderne med ureido -enheder. Disse oligoureaer, som er sammensat af urinstof-baserede enheder, foldes ind i en struktur, der ligner den for peptider. Oligourea-baserede "falske" peptider forbedrer mulighederne for rationelt lægemiddeldesign, afslutter undersøgelsen offentliggjort i tidsskriftet Angewandte Chemie .
Flere lægemidler er peptider, der hæmmer eller aktiverer virkningen af visse proteiner. For at forbedre deres effektivitet, forskere undersøger peptidefterligninger. Peptidefterligninger indeholder tråde af små organiske enheder, der ligner aminosyrer - byggestenene i peptider - men er ikke identiske med dem. Begrundelsen er, at proteolytiske enzymer mindre sandsynligt vil angribe sådanne falske peptidstrenge, så stofferne ville være mere effektive.
Imidlertid, de syntetiske tråde - kaldet oligomerer - skal foldes ind i strukturen af det originale peptid for at binde til dets målprotein korrekt. Gilles Guichard og hans team fra CNRS, University of Bordeaux, og kolleger fra University of Strasbourg og Ureka Pharma, Mulhouse, Frankrig, har udforsket oligomerer lavet af ureido -enheder, som er derivater af urinstof. Disse oligoureaer foldes til en spiral, en af peptidernes kendetegnende strukturer. Imidlertid, der er små forskelle. "Oligourea spiraler har færre rester pr. Tur, en mindre stigning pr. tur, og en større diameter end det oprindelige peptid alfa-helix, "siger Guichard.
For at afgøre, om oligourea kan efterligne rigtige peptidstrukturer, forskerne forberedte peptid -oligourea -hybrider og undersøgte deres binding til målproteiner. Et af målene, MDM2, er en naturlig regulator af tumorsuppressorproteinet p53. Den anden, VDR, er et protein, der kræves i reguleringen af cellevækst, immunitet, og andre biologiske funktioner.
For det MDM2-bindende peptid efterligner, forskerne forberedte hybrider ved at erstatte tre terminale centrale aminosyrer med ureido -enheder. For det VDR-bindende peptid efterligner, de erstattede det midterste aminosyresegment med ureido -enheder. Efter nogle runder med optimering, forfatterne fandt hybridstrukturer med høje bindingsaffiniteter.
Bindingsaffiniteterne lignede dem for de originale peptider. I øvrigt, Røntgenanalyse afslørede, at hybridstrukturer vedtog en almindelig spiralformet struktur. Imidlertid, spiralerne var stadig en smule bredere og havde større mellemrum mellem sidekæderne langs oligourea -rygraden end for naturlige peptider.
Peptid -oligourea -hybrider forventes at modstå proteolytisk nedbrydning, et vigtigt mål inden for medicinsk kemi. En anden fordel er, at de tillader flere ændringer. "Alfa -aminosyrer kan substitueres i to positioner, men ureido -enheder har et websted mere, "siger Guichard. Det betyder, at hybridpeptid -oligourea -lægemidler tilbyder flere muligheder for optimering.
 Varme artikler
Varme artikler
-
 Ny kapacitet til DNA -forstærkning giver løfte om bekæmpelse af sygdommeDNA -amplifikationsproces i kunstige celler. Kredit:Yusuke Sato, Tokyo Institute of Technology DNA -amplifikation - en molekylær fotokopiering teknik, hvor genetisk materiale replikeres - har mang
Ny kapacitet til DNA -forstærkning giver løfte om bekæmpelse af sygdommeDNA -amplifikationsproces i kunstige celler. Kredit:Yusuke Sato, Tokyo Institute of Technology DNA -amplifikation - en molekylær fotokopiering teknik, hvor genetisk materiale replikeres - har mang -
 Uvridende plastik til opladning af Internet-of-Things-enhederTil venstre:Forskerne fandt ud af, at deres dopingteknik dannede bindinger (røde) mellem PBTTTs krystallinske dele (blå rektangler). Til højre:De fandt også ud af, at PBTTT var snoet i sin naturlige t
Uvridende plastik til opladning af Internet-of-Things-enhederTil venstre:Forskerne fandt ud af, at deres dopingteknik dannede bindinger (røde) mellem PBTTTs krystallinske dele (blå rektangler). Til højre:De fandt også ud af, at PBTTT var snoet i sin naturlige t -
 Lille tornado øger ydeevnen af elektrospray-ioniseringsmassespektrometriDRILL-enheden er forbundet til et massespektrometer for at sortere ladede dråber og forbedre desolvation af ioniserede biomolekyler til analyse. Enheden kræver ingen ændring af massespektrometeret, og
Lille tornado øger ydeevnen af elektrospray-ioniseringsmassespektrometriDRILL-enheden er forbundet til et massespektrometer for at sortere ladede dråber og forbedre desolvation af ioniserede biomolekyler til analyse. Enheden kræver ingen ændring af massespektrometeret, og -
 Enkeltkrystallinske kvaternære sulfid -nanobelterKobberbaserede kvaternære sulfid-nanomaterialer, især for Cu-Zn-In-S (CZIS) og Cu-Zn-Ga-S (CZGS), som består af giftfri elementer er attraktive kandidater til solfotokatalytisk brintproduktion på grun
Enkeltkrystallinske kvaternære sulfid -nanobelterKobberbaserede kvaternære sulfid-nanomaterialer, især for Cu-Zn-In-S (CZIS) og Cu-Zn-Ga-S (CZGS), som består af giftfri elementer er attraktive kandidater til solfotokatalytisk brintproduktion på grun


