En ny synder i antibakteriel resistens:Cysteinpersulfid
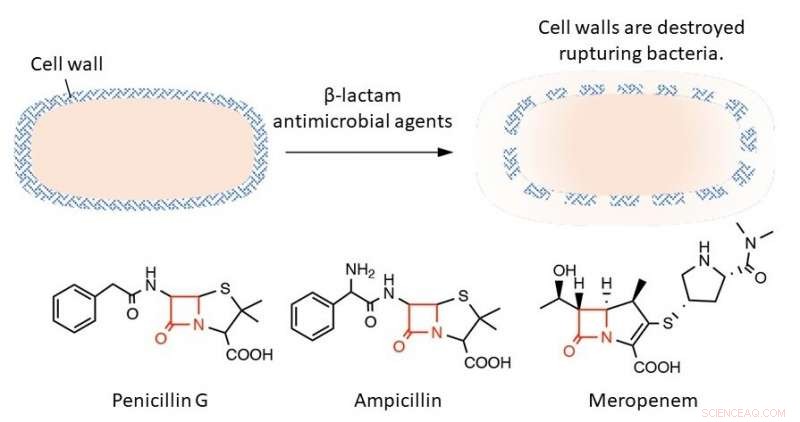
Øverst:β-lactam antimikrobielle midler sprænger bakterier ved at ødelægge deres cellevægge. Nederst:Den røde tekst i strukturformlen repræsenterer β-lactamringen, som er afgørende for bakteriedræbende virkning. Kredit:Professor Tomohiro Sawa
Et fælles forskningsprojekt baseret på Kumamoto University, Japan har udviklet en ny, meget følsom analysemetode, der kan påvise nedbrudte β-lactam antibakterielle midler, der anvendes til behandling af bakterielle infektioner. Med denne metode, forskere fandt ud af, at reaktive svovlarter produceret af bakterier nedbryder og inaktiverer β-lactam-antibiotika.
Bakterier er forskellige fra dyreceller ved, at deres ydre lag er dækket af en stiv struktur kaldet en cellevæg. β-lactam antimikrobielle midler interfererer med de processer, der danner cellevæggen. Dette resulterer i, at bakterier ikke længere kan modstå deres eget indre tryk, så de brister og dør. β-lactam antimikrobielle midler er meget potente, fordi de selektivt hæmmer bakteriel cellevægssyntese og har få bivirkninger på værter såsom mennesker. Disse antimikrobielle midler har en fælles struktur kaldet β-lactamringen, som er essentiel for at hæmme cellevægsudviklingen. Hvis denne ring er forringet, den antimikrobielle virkning forsvinder.
Tidligere undersøgelser har rapporteret, at svovlbrinte (H2S), som bakterier producerer under svovlmetabolisme, reducerer deres modtagelighed over for antimikrobielle midler, hvilket fører til resistens. Imidlertid, den detaljerede mekanisme, der forårsager dette, er endnu ikke forstået. Forskere ved Kumamoto University har tidligere vist, at molekylet cysteinpersulfid, en kombination af H2S og aminosyren cystein, har en ekstremt potent antioxidantvirkning, som ikke findes i H2S eller cystein alene.

Hydrogensulfid (H2S) er knyttet til thiolgruppen (-SH) af cystein. Kredit:Professor Tomohiro Sawa
I dette studie, forskere undersøgte, hvordan denne reaktive svovlart er involveret i erhvervelsen af resistens over for β-lactam-antibiotika. De opdagede, at β-lactam antibiotika såsom penicillin G, ampicillin, og meropenem (carbapenem-antibiotika) mister hurtigt bakteriedræbende aktivitet, når de udsættes for cysteinpersulfid, men ikke med hydrogensulfid. En detaljeret undersøgelse af reaktionen mellem β-lactam antimikrobielle midler og cysteinpersulfid afslørede, at β-lactamringen, som er afgørende for bakteriedræbende virkning, nedbrydes, og et svovlatom indsættes i en del af ringen, hvilket skaber carbothiosyre. Produktionen af carbothiosyre fra et β-lactam antimikrobielt middel ser ud til at være en ny nedbrydningsmetabolit.
Forskere udviklede således en meget følsom analytisk metode til at detektere og kvantificere carbothiosyre ved hjælp af massespektrometri, og derefter analyseret carbothioinsyreproduktion fra bakterier, der blev udsat for β-lactam antimikrobielle stoffer. De fandt ud af, at bakterier kan absorbere antimikrobielle midler og bruge cysteinpersulfid til at nedbryde midlerne til carbothiosyre, som derefter udledes. Dette menes at være en tidligere ubeskrevet inaktiverings- og nedbrydningsmekanisme af β-lactam antimikrobielle midler til carbothiosyre af cysteinpersulfid.
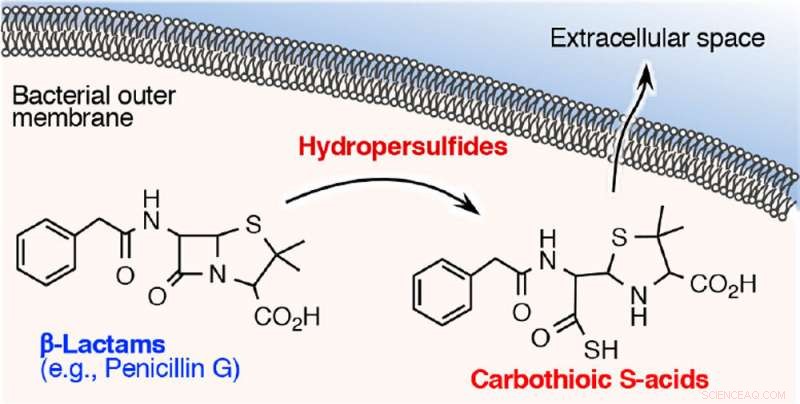
β-lactam antimikrobielle midler inde i bakterierne nedbrydes til carbothiosyre og udledes derefter. Kredit:Professor Tomohiro Sawa
"Vores nyudviklede analysemetode gør det muligt at kvantificere mængden af carbothiosyre, der udledes fra bakterier med høj følsomhed, " sagde professor Tomohiro Sawa, der ledede undersøgelsen. "Vi tror på, at det vil være muligt at screene for forbindelser, der hæmmer bakteriel syntese af cysteinpersulfid ved at bruge carbothiosyre som biomarkør. Sådan en cysteinpersulfidsyntesehæmmer i kombination med β-lactamantibiotika forventes at hæmme antibiotikanedbrydning og resultere i vellykkede behandlinger. med en lavere koncentration af β-lactam-antibiotika. Dette skulle også være med til at reducere fremkomsten af nye resistente bakterier."
Denne undersøgelse blev lagt online i ACS Kemisk Biologi den 30. marts 2021.
 Varme artikler
Varme artikler
-
 Interferens fører til unøjagtig Raman-spektroskopisk analyse af vitamin B12Kredit:Wiley Mange naturlige produkter er komplicerede organiske molekyler. På trods af denne kompleksitet, videnskabsmænd er normalt i stand til at undersøge dem ved hjælp af spektroskopiske tekn
Interferens fører til unøjagtig Raman-spektroskopisk analyse af vitamin B12Kredit:Wiley Mange naturlige produkter er komplicerede organiske molekyler. På trods af denne kompleksitet, videnskabsmænd er normalt i stand til at undersøge dem ved hjælp af spektroskopiske tekn -
 En enklere model kommer til sagen med proteinerCecilia Clementi. Kredit:Jeff Fitlow/Rice University Beregningsmodeller er kommet langt i deres evne til at simulere de mest basale biologiske processer, såsom hvordan proteiner folder. En ny tekn
En enklere model kommer til sagen med proteinerCecilia Clementi. Kredit:Jeff Fitlow/Rice University Beregningsmodeller er kommet langt i deres evne til at simulere de mest basale biologiske processer, såsom hvordan proteiner folder. En ny tekn -
 Silikoner opnået ved lave temperaturer ved hjælp af luftKredit:CC0 Public Domain Russiske forskere har udviklet en ny metode til syntetisering af para-carboxyplenylsiloxaner, en unik klasse af organosiliciumforbindelser. De resulterende forbindelser er
Silikoner opnået ved lave temperaturer ved hjælp af luftKredit:CC0 Public Domain Russiske forskere har udviklet en ny metode til syntetisering af para-carboxyplenylsiloxaner, en unik klasse af organosiliciumforbindelser. De resulterende forbindelser er -
 På vej til en kunstig celleCeller lavet af vand i olie:Ved hjælp af mikrofluidikteknologi, et fransk-tysk forskerhold genererer først små dråber (øverst), hvori komponenterne i et simpelt stofskifte derefter injiceres (nederst)
På vej til en kunstig celleCeller lavet af vand i olie:Ved hjælp af mikrofluidikteknologi, et fransk-tysk forskerhold genererer først små dråber (øverst), hvori komponenterne i et simpelt stofskifte derefter injiceres (nederst)
- At skabe en renere fremtid for transport
- ICESat-2 satellit afslører form, dybden af Antarktis ishyldebrud
- Neptunens indre struktur
- Twitter tilføjer en måde at rapportere vælgertricks på
- 5G trådløs til at forbinde robotter på jorden til AI i skyen
- Undersøgelse forstyrrer venturekapitalistiske antagelser om skattefordele for virksomheder


