Styrken af bakteriel adhæsion afhænger ikke af størrelsen på kontaktområdet
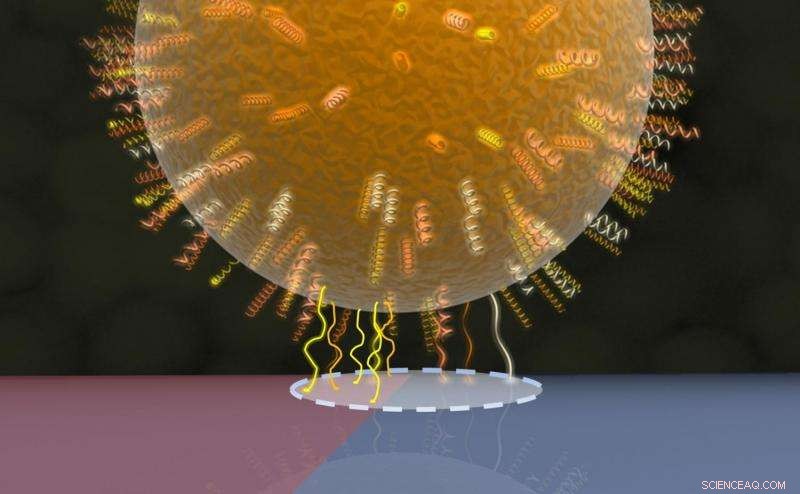
Model af bakteriekontaktområdet:Cellevægsproteiner i et cirkulært område (stiplet linje) kommer i kontakt med den underliggende overflade, hvoraf den ene halvdel er vist med rødt (hydrofobt område med flere proteinkontakter) og den anden halvdel med blåt (hydrofilt område med færre proteinkontakter). Kredit:AG Jacobs
Et team af fysikere og biologer, der arbejder ved Saarlands Universitet, har udviklet en metode, hvormed de kan måle kontaktområdet mellem en bakterie og den overflade, den 'sidder' på. Interessant nok, og måske kontraintuitivt, et stort kontaktareal betyder ikke nødvendigvis en stor klæbekraft. Det viser sig, at bakteriens specifikke træk, som resulterer i lokale forskelle i sammensætningen af proteinerne i cellevæggen, er hovedårsagerne til de observerede forskelle i vedhæftning. Disse resultater kan nu bruges til at optimere antibakterielle materialer. Forskningsarbejdet offentliggøres i dag i tidsskriftet Nanoskala .
Bakterier af arten Staphylococcus aureus er blandt de mest udbredte og farlige patogener i vor tid. En af grundene til deres effektivitet er deres evne til at klæbe til både syntetiske og naturlige overflader, hvor de danner meget persistente biofilm. Disse biofilm beskytter effektivt de individuelle patogener, hvilket gør dem meget vanskelige at fjerne fra en overflade. Dette er grunden til, at deres tilstedeværelse på medicinske implantater er så frygtet, og hvorfor de er en væsentlig årsag til postoperativ infektion. En tilgang til at forhindre infektion er derfor at forhindre dannelsen af biofilmen. Men for at kunne påvirke væksten af biofilm, forskere er nødt til at forstå den mekanisme, hvorved bakterierne klæber til overflader. For eksempel, det ville være nyttigt at vide, præcis hvilken brøkdel af overfladearealet af en enkelt bakteriecelle, der faktisk er i kontakt med overfladen. Imidlertid, da disse sfæriske bakterier kun er en mikrometer på tværs (ca. en hundrededel af tykkelsen af et menneskehår), det var usandsynligt, at konventionel lysmikroskopi kunne bruges til at bestemme kontaktområdet.
Saarlands universitetsteam ledet af den eksperimentelle fysiker professor Karin Jacobs og mikrobiologen professor Markus Bischoff gjorde derfor brug af en anden egenskab ved bakterien, nemlig at den adhæsionsstyrke, som forskellige bakteriearter udviser, ofte afhænger stærkt af den type overflade, den er placeret på. For eksempel, de bakterier, der var i fokus for denne undersøgelse, hæfter sig meget mere effektivt til stærkt hydrofobe overflader end til fugtbare (hydrofile) overflader. Forskerne skabte derfor en siliciumbaseret overflade, der udviste begge egenskaber - stærkt hydrofob i én region, meget fugtbar i en anden - inden for et ekstremt lille område. Den adhæsive kraft, som individuelle bakterier udøver på denne specielt forberedte overflade, blev derefter målt ved hjælp af et scanning atomic force mikroskop, kendt som et kraftspektroskop.
Metoden går ud på at bringe en enkelt bakteriecelle i minimal kontakt med overfladen og derefter måle den kraft, der kræves for at løsne bakterien fra den overflade. Dette er klæbekraften. På den hydrofobe (bogstaveligt talt 'vandhatende') del af overfladen, kraften er cirka ti gange større end den, der er nødvendig, når bakteriecellen klæber til det hydrofile ('vandelskende') område. Denne procedure gentages derefter med bakteriecellen placeret successivt tættere på grænsen mellem de hydrofobe og hydrofile regioner, derefter måles kraften med bakterien placeret på selve grænsen og til sidst med bakterien beliggende i den rent hydrofile zone, hvor klæbekraften er svagest. Måledataene relaterer klæbekraften af en enkelt celle til dens nøjagtige position på den specielt tilpassede overflade, og derfor til overfladens fugtbarhed, har givet Saarbrücken-forskerholdet mulighed for at udlede størrelsen af kontaktområdet mellem bakterien og overfladen. Metoden kan også bruges til andre målinger, såsom bestemmelse af den klæbende kraft af kolloide partikler, som også er kugleformede.
Forskerholdet opdagede, at diameteren af kontaktområdet, som antages at være cirkulær, var af størrelsesordenen nogle få tiere til flere hundrede nanometer (et tusinde nanometer svarer til en tusindedel af en millimeter), og at størrelsen af kontaktområdet kan variere betydeligt mellem forskellige individuelle celler af samme art Staphylococcus aureus. Med henblik på sammenligning, et ikke-patogent medlem af slægten Staphylococcus blev også undersøgt, som klæber langt mindre stærkt til overfladen end patogenet Staphylococcus aureus. Det er særligt forbløffende, at størrelsen af kontaktområdet absolut ikke har nogen indflydelse på styrken af adhæsionen mellem en bakteriecelle og overfladen. Forskerne var også i stand til at påvise, at på trods af deres sfæriske form, bakterierne kan ikke blot beskrives som hårde kugler, når de interagerer med en overflade. En mere præcis beskrivelse er at tænke på dem som bolde, der er dækket med en blød, shaggy og ujævn belægning af cellevægsproteiner, og at denne pels er den vigtigste faktor, der bestemmer adhæsion mellem cellen og overfladen. Den udtalte lokale variabilitet i klæbekraften afspejler de forskellige sammensætninger af grupperne af cellevægsproteiner, som bestemmer, hvor stærkt et område af cellens overflade er i stand til at klæbe til en overflade.
Den tilgang, der er brugt i undersøgelsen, kan bl. i princippet, kan anvendes på alle andre arter af bakterielle patogener, uanset om de er sfæriske eller stavlignende i form. Resultaterne kan meget vel bane vejen til at udvikle overflader, hvis morfologi omhyggeligt kan justeres for at ændre disse klæbende kræfter, undertrykker dermed vedhæftningen af uønskede bakterielle patogener, eller, alternativt, fremme vedhæftning af bakterier, som dem, der bruges til bortskaffelse af affald, hvis tilstedeværelse ønskes.
 Varme artikler
Varme artikler
-
 Lavpris CO-sensor udviklet ved hjælp af nanoskala honeycomb-strukturerHoneycomb type ZnO nanostruktur. Kredit:Indian Institute of Science Forskere ved Indian Institute of Science (IISc) har udviklet en meget følsom, lavpris nanosensor, der hurtigt kan registrere små
Lavpris CO-sensor udviklet ved hjælp af nanoskala honeycomb-strukturerHoneycomb type ZnO nanostruktur. Kredit:Indian Institute of Science Forskere ved Indian Institute of Science (IISc) har udviklet en meget følsom, lavpris nanosensor, der hurtigt kan registrere små -
 Hurtig mobiltelefonopladning kommer tættere på virkelighedenKredit:ACS Evnen til at oplade mobiltelefoner på få sekunder er et skridt nærmere, efter at forskere ved University of Waterloo brugte nanoteknologi til markant at forbedre energilagringsenheder k
Hurtig mobiltelefonopladning kommer tættere på virkelighedenKredit:ACS Evnen til at oplade mobiltelefoner på få sekunder er et skridt nærmere, efter at forskere ved University of Waterloo brugte nanoteknologi til markant at forbedre energilagringsenheder k -
 Molekylær fakkel mellem carbon nanorør udsender elektroluminescensFor første gang, forskere observerede elektroluminescens fra et molekyle, der lå i et hul mellem kulnanorør. Billedkredit:Karlsruhe Institute of Technology. (PhysOrg.com)-Et enkelt molekyle, der b
Molekylær fakkel mellem carbon nanorør udsender elektroluminescensFor første gang, forskere observerede elektroluminescens fra et molekyle, der lå i et hul mellem kulnanorør. Billedkredit:Karlsruhe Institute of Technology. (PhysOrg.com)-Et enkelt molekyle, der b -
 Ny metode til at skabe mesoporøse materialer fra industrielle polymererEt skematisk billede af en mesoporøs polymer. Polymersamlinger i nanofiberform med porer på 10 til 20 nm i diameter forgrenes på en sofistikeret måde for at skabe en lille tredimensionel netværksstruk
Ny metode til at skabe mesoporøse materialer fra industrielle polymererEt skematisk billede af en mesoporøs polymer. Polymersamlinger i nanofiberform med porer på 10 til 20 nm i diameter forgrenes på en sofistikeret måde for at skabe en lille tredimensionel netværksstruk
- Brug af dendrokronologi til at datere gamle musikinstrumenter
- Døde træer er levende med svampe
- Sådan Find Triangles Side Længder
- Pengeproblemer gør folk mere utilfredse end ensomhed gør under lockdown, undersøgelse finder
- NASA finder en vis styrke i den nye tropiske depression i det østlige Stillehav
- NASA fanger den tropiske depression Kai-Taks sidste bue


