Forskellige amyloidstrukturer og dynamik afsløret ved højhastigheds atomkraftmikroskopi
Kredit:Unsplash/CC0 Public Domain
I den menneskelige krop, proteiner forekommer nogle gange i fibrillære aggregater kaldet amyloider. Selvom visse amyloider vides at have en biologisk funktion, amyloiddannelse er ofte forbundet med patologier, herunder Alzheimers og Parkinsons sygdomme. At forstå, hvordan præcis amyloidfibriller dannes, er afgørende for at få indsigt i udviklingen af sådanne sygdomme og for at komme videre med behandlingsmetoder.
Nu, Takahiro Watanabe-Nakayama fra Kanazawa University, Kenjiro Ono fra Showa University, og kolleger har undersøgt dannelsesprocessen af bestemte amyloidfibriller ved hjælp af en teknik, der muliggør visualisering af vækst over tid. Forskerne så specifikt på effekten af krydssåning ('blanding') af forskellige proteiner, der danner aggregater, og fandt variationer i forlængelseshastigheder og fibrillernes struktur.
Forskerne undersøgte alfa-synuclein, et protein, der er rigeligt i den menneskelige hjerne. De så på, hvad der skete, da de lod vildtype alfa-synuclein-molekyler - de naturlige, mest udbredte variant - danner aggregater, og også hvordan aggregering er anderledes, når man introducerer (kryds-seeding) mutante varianter forbundet med Parkinsons sygdom. Ud over, forskerne undersøgte indflydelsen af pH-niveauet i det mikromiljø, hvori fibrilvækst finder sted.
Ved hjælp af højhastigheds atomkraftmikroskopi (HS-AFM), Watanabe-Nakayama, Ono og kolleger kunne optage fibrilaggregation ved nanometeropløsning og høj videohastighed for forskellige tilfælde. Først, forskerne så på væksten af enkelte varianttyper (selvsåning). De fandt ud af, at mutanter producerede flere aggregater, eller at de aggregerede hurtigere ved neutral pH end vildtypevarianterne. En anden observation var, at forlængelsen var hurtigere ved lavere pH (5,8, surt) end ved højere pH (7,4, dvs. grundlæggende).
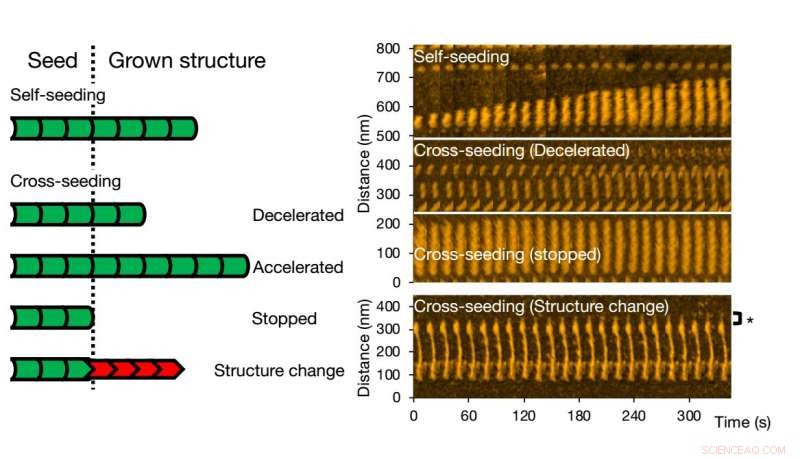
Højhastigheds atomkraftmikroskopi gør det muligt at visualisere og analysere fibrildannelse af varianter af et enkelt protein. Kredit:Kanazawa University
Til krydssåning, forskellige scenarier kan opstå. Fibrilvækst kan accelereres eller bremses, eller endda stoppet. Morfologien af det oprindelige frø kan bevares, men det sker også, at strukturen af den resulterende fibril er anderledes - typiske strukturelle former er 'lige' eller 'spiralformede'. Forskerne kontrollerede, at fibrillens struktur og dynamik som observeret med HS-AFM svarer til processerne i opløsning ved hjælp af fluorescenseksperimenter; lignende konklusioner blev opnået.
Resultaterne af Watanabe-Nakayama, Ono og kolleger er relevante for bedre at forstå amyloid-relaterede sygdomme. Citerer forskerne:"Krydsseedning kombineret med variationer i forlængelseshastigheder har den virkning at øge den strukturelle mangfoldighed af de resulterende samlinger. Denne mangfoldighed kan afspejles i særskilte neurotoksiske effekter for forskellige [protein] samlinger."
 Varme artikler
Varme artikler
-
 Bedre adskillelser med tilpassede nanopartikelmembranerNanopartikelmembraner i aktion:(øverst) en film af guldnanopartikler på et porøst substrat og transportvejen for et ladet molekyle (blå kugle), der bevæger sig gennem en udækket pore; (nederst) er hve
Bedre adskillelser med tilpassede nanopartikelmembranerNanopartikelmembraner i aktion:(øverst) en film af guldnanopartikler på et porøst substrat og transportvejen for et ladet molekyle (blå kugle), der bevæger sig gennem en udækket pore; (nederst) er hve -
 Ny rekord om presning af lys til ét atom:Atomic Lego guider lys under et nanometerKunstnerisk indtryk af det pressede lys (plasmon) mellem metallet og grafen, adskilt af kun en en-atom tyk dielektrisk Kredit:ICFO Alle elektroniske enheder består af milliarder af transistorer, d
Ny rekord om presning af lys til ét atom:Atomic Lego guider lys under et nanometerKunstnerisk indtryk af det pressede lys (plasmon) mellem metallet og grafen, adskilt af kun en en-atom tyk dielektrisk Kredit:ICFO Alle elektroniske enheder består af milliarder af transistorer, d -
 En lysudløst rengøringsvenlig, genanvendelig chip gør fremstilling mulig for alleSelvrensende, genanvendelige skabeloner til proteinmønstre er fremstillet ved hjælp af både nanoimprint og interferometrisk litografi. Smid vaskemidlet væk og afstå fra albuefedtet:irriterende pro
En lysudløst rengøringsvenlig, genanvendelig chip gør fremstilling mulig for alleSelvrensende, genanvendelige skabeloner til proteinmønstre er fremstillet ved hjælp af både nanoimprint og interferometrisk litografi. Smid vaskemidlet væk og afstå fra albuefedtet:irriterende pro -
 Molekylær fakkel mellem carbon nanorør udsender elektroluminescensFor første gang, forskere observerede elektroluminescens fra et molekyle, der lå i et hul mellem kulnanorør. Billedkredit:Karlsruhe Institute of Technology. (PhysOrg.com)-Et enkelt molekyle, der b
Molekylær fakkel mellem carbon nanorør udsender elektroluminescensFor første gang, forskere observerede elektroluminescens fra et molekyle, der lå i et hul mellem kulnanorør. Billedkredit:Karlsruhe Institute of Technology. (PhysOrg.com)-Et enkelt molekyle, der b
- Hvad lærte man stadig af Exxon Valdez miljødebacle 3 årtier senere
- Ny undersøgelse tyder på, at galaktiske bulemissioner ikke skyldes mørkt stof
- Hvilke celler vil du bruge til at udtrække DNA fra en levende person?
- Sticky bølger - molekylære interaktioner på nanoskala
- Arrays af små koniske spidser, der skubber ioniserede materialer ud, kunne fremstille enheder i nan…
- Planets


