Zebrafiskembryoner hjælper med at bevise, hvad der sker med nanopartikler i blodet
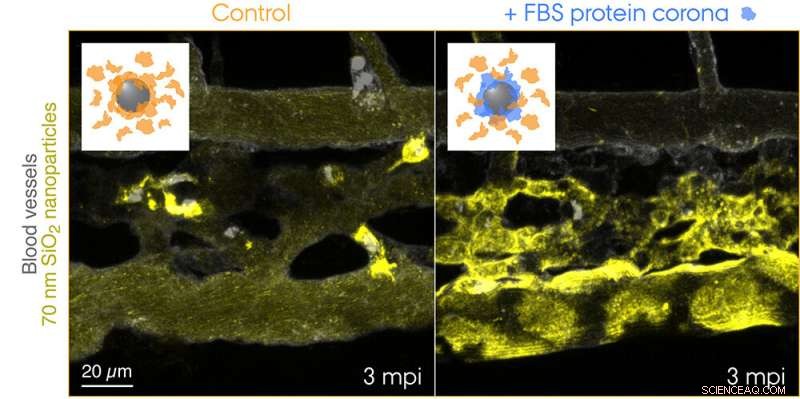
Fluorescensmærkede 70 nm SiO2 nanopartikler blev injiceret i blodbanen af 3 dage gamle transgene zebrafisk embryoner og live-billede 3 minutter efter injektionen. Indsætningerne viser skemaer for de to testede tilstande:kontrol nanopartikler med en corona af endogene proteiner (orange) og nanopartikler med en foruddannet corona af føtalt bovint serum (FBS) proteiner (blå) og yderligere endogene proteiner. Kontrol nanopartikler fanges hurtigt af makrofager, mens nanopartiklerne med en ikke-selv biologisk identitet effektivt sekvestreres af scavenger endotelceller. Kredit:Yuya Hayashi. Tilpasset fra Mohammad-Beigi et al. (2020) ACS Nano. Copyright 2020 American Chemical Society
En række nanopartikler er designet til målrettet lægemiddellevering, men desværre er det kun en meget lille del af de injicerede nanopartikler, der når målstedet, såsom solide tumorer. Årsagen til den lave målretningseffektivitet betragtes ofte som en "sort boks" og havde derfor været lidt udforsket i mange år.
For nylig, et internationalt forskerhold ledet af Yuya Hayashi fra Institut for Molekylær Biologi og Genetik (MBG), Aarhus Universitet, demonstreret skønheden ved zebrafiskembryoner i nano-bioimaging, der kan visualisere dynamiske interaktioner mellem nanopartikler og celler af interesse i en levende organisme (se en anden artikel "Zebrafisk lader dig se den biologiske skæbne for nanopartikler in vivo").
Nu, samarbejder med forskere fra Interdisciplinary Nanoscience Center (iNANO), Yuya søger at besvare uløste mysterier inden for bionanovidenskab - den første i rækken er det biologiske identitetsbegreb, som forklarer, hvordan celler genkender nanopartikler gennem en "corona" af proteiner, der omgiver hver partikel. Dette koncept er nu blevet bevist for første gang i en levende organisme ved brug af zebrafiskembryoner, der afslører, hvad der sker med nanopartikler, der sprøjtes ind i blodet.
Ven eller fjende? Hvordan biologiske systemer genkender nanopartikler
"What the Cell Sees in Bionanoscience" er en af de tidlige publikationer, der har defineret, hvordan en korona af proteiner dannes omkring en nanopartikel, og hvordan en sådan proteincorona indebærer behovet for at genoverveje den måde, vi ser på nanopartikler i et biologisk miljø. Fra omfattende forskning i det seneste årti, vi forstår nu, at to modsatrettede effekter hovedsageligt bidrager til nanopartikeloptagelse af celler. Generelt, proteinet corona forhindrer nanopartikeloverfladen i direkte fysiske interaktioner med cellemembranen. Imidlertid, hvad nu hvis proteinet corona præsenterer et signal, der udløser en specifik biologisk interaktion med receptorer udplaceret på cellemembranen? Det er noget cellen ser og dermed giver nanopartikler en biologisk identitet.
Nu har forskerne fra Aarhus Universitet således leveret det første "visuelle" bevis for proteinet coronas slående bidrag til nanopartikel-clearance fra blodet, der medførte uønskede udfald i zebrafiskembryomodellen. Forskerholdet brugte en arts-mismatchende kilde til proteiner til corona-dannelsen til at skabe en "ikke-selv" biologisk identitet og sporede nanopartiklernes rejse gennem blodet og til deres endelige destination - endolysosomer i cellen. Dette afslørede overraskende hurtig optagelse og forsuring af nanopartiklerne af scavenger-endotelceller (funktionelt ækvivalent med leverens sinusoidale endotelceller hos pattedyr) efterfulgt af pro-inflammatorisk aktivering af makrofager (se filmen på Yuyas gruppewebside).
"Det lyder som en skør idé at injicere nanopartikler med proteiner fra et andet dyr, " siger Yuya, "men f.eks. biomolekyle-inspirerede nanomedicin testes i en musemodel uden særlige bekymringer for den arts-mismatchede kombination. Eller også humaniserer nogle kloge mennesker musen for at tage sig af artskompatibilitetsproblemet. Faktisk, selv på cellekulturniveau testes nanopartikler stadig rutinemæssigt efter traditionen for at bruge serumtilskud fra køer, mens man ved, at nanopartikel-protein-interaktioner er en nøglefaktor for cellulær optagelse."
"Det, der gør denne slags eksperimenter ret udfordrende, er, " tilføjer førsteforfatter Hossein Mohammad-Beigi, "for maksimalt at bevare det oprindelige protein corona i en levende organisme. Hvis den foruddannede corona hurtigt bliver udskiftet med endogene blodproteiner, den testede hypotese bliver ugyldig. Vi har gjort en del indsats for at karakterisere proteinet corona for at sikre, at nanopartiklerne bevarer den ikke-selv biologiske identitet."
At se er at tro - zebrafiskmodellen kan tilbyde, hvad gnavermodeller ikke kan
Den største fordel ved zebrafiskmodellen er dens kraft i realtidsbilleddannelse i flere farver, hvorved flere kombinationer af fluorescenssporstoffer og reporterproteiner kan afbildes i en simpel opsætning ved høj rumlig-temporal opløsning. Dette giver en ny mulighed, der ligger mellem mindre realistiske cellekultursystemer og mere udfordrende gnavereksperimenter såsom intravital mikroskopi.
"Ved brug af cellekulturer, vi har lært ret meget om, hvordan celler genkender nanopartikler snarere som dynamiske aggregater af proteiner, men det blev aldrig testet i en mere realistisk situation, " Yuya forklarer. "Med etableringen af zebrafiskmodellen, vi har endelig fået et middel til at udforske dette spørgsmål yderligere i en levende organisme. Det var en enkel tilgang med et ekstremt scenarie testet i et meget komplekst system, men jeg tror på, at vi nu er et skridt tættere på at forstå, hvad proteinet corona virkelig kan betyde for nanopartikler. I et miljø rigt på proteiner, nanopartikler kan bære en maske, der giver dem en biologisk identitet, og dets ikke-selvhed kan gøre dem til en fjende. Hvad definerer graden af ikke-selvheden? Godt, det er det næste store spørgsmål, vi skal løse."
 Varme artikler
Varme artikler
-
 Forskere får indsigt i genbrugsprocesser for nukleart og elektronisk affaldForskere brugte røntgenspredningsteknikker (øverst) og sumfrekvensgenereringsspektroskopi (nederst) til at studere separationsmekanismerne ved grænsefladen mellem vand og olie (afbildet her) under eks
Forskere får indsigt i genbrugsprocesser for nukleart og elektronisk affaldForskere brugte røntgenspredningsteknikker (øverst) og sumfrekvensgenereringsspektroskopi (nederst) til at studere separationsmekanismerne ved grænsefladen mellem vand og olie (afbildet her) under eks -
 Kunstigt fotosyntesesystem får effektivitetsboost fra grafenIllustration af det kunstige fotosyntesesystem ved hjælp af en grafen-baseret fotokatalysator til at producere myresyre fra kuldioxid under synligt lys. Billedkredit:Yadav, et al. ©2012 American Chemi
Kunstigt fotosyntesesystem får effektivitetsboost fra grafenIllustration af det kunstige fotosyntesesystem ved hjælp af en grafen-baseret fotokatalysator til at producere myresyre fra kuldioxid under synligt lys. Billedkredit:Yadav, et al. ©2012 American Chemi -
 Nye nanotråde øger brændselscelleeffektivitetenTaylor og Schroers konstruerede nanotråde af et nyt materiale kaldet bulkmetallglas for at gøre brændselscellekatalysatorsystemer mere holdbare og effektive. Kredit:Golden Kumar og Miriam Schroers/Yal
Nye nanotråde øger brændselscelleeffektivitetenTaylor og Schroers konstruerede nanotråde af et nyt materiale kaldet bulkmetallglas for at gøre brændselscellekatalysatorsystemer mere holdbare og effektive. Kredit:Golden Kumar og Miriam Schroers/Yal -
 Grafenbaseret blæk kan føre til energilagringsenheder, der kan udskrives(Top) Den salt-templatede proces med at syntetisere grafen nanoark til blæk. (Bund) Blæk og trykte demonstration. Kredit:Wei et al. ©2019 American Chemical Society Forskere har lavet en blæk lavet
Grafenbaseret blæk kan føre til energilagringsenheder, der kan udskrives(Top) Den salt-templatede proces med at syntetisere grafen nanoark til blæk. (Bund) Blæk og trykte demonstration. Kredit:Wei et al. ©2019 American Chemical Society Forskere har lavet en blæk lavet
- Fosforescerende materiale inspireret af glød i det mørke træ
- Levering af nye koncepter til byborgere
- Edderkoppesilke:Et formbart protein giver forstærkning
- Sådan beregnes friktionskraften
- Kan byer blive klogere på ekstremt vejr?
- Hvad er udtrykt, når hverken kopi af en allel fuldstændig masker ekspression?


