Edderkoppesilke:Et formbart protein giver forstærkning

Figuren viser et edderkoppespind sammen med den undersøgte domænes molekylære struktur i bunden tilstand i overfladerepræsentation (struktur i rød/orange, øverste venstre hjørne). Aminosyrens methionins sidekæder, som er placeret i kernen af det domæne, hvor de tjener til at formgøre strukturen, fremhæves som farvede pinde. Kredit:Pixaby.com / Collage:Hannes Neuweiler
Hvorfor er web -edderkoppers lette silketråde hårdere end de fleste andre materialer? Forskere fra universiteterne i Würzburg og Mainz gik sammen om at finde svar på dette spørgsmål. De var i stand til at vise, at den naturlige aminosyre methionin giver plasticitet til et proteindomæne, som er en konstitutiv del af edderkoppesilke. Denne plasticitet øger bindingsstyrken mellem de enkelte domæner betydeligt. Forskerne har offentliggjort deres resultater i det aktuelle nummer af Naturkommunikation .
Materiale med mange anvendelsesmuligheder
Undersøgelsen ledes af Dr. Hannes Neuweiler, en foredragsholder og gruppeleder ved Institut for Bioteknologi og Biofysik ved Würzburg Universitet. Han har studeret edderkoppesilkeproteiner i mange år - eller mere præcist deres molekylære egenskaber. "Edderkoppesilke er et af de hårdeste materialer, der findes i naturen. Det er stærkere i vægt end højteknologiske fibre som Kevlar eller kulstof, "Siger Neuweiler. Den unikke kombination af sejhed og elasticitet gør det meget attraktivt for industrien. Uanset om det er inden for luftfart, tekstilindustrien eller medicin, potentielle anvendelser af dette fremragende materiale er mange.
Selvom syntetisk edderkoppesilke allerede produceres i industriel skala og bruges i forskellige produkter, den er endnu ikke i stand til at efterligne de fremragende mekaniske egenskaber ved den naturlige plan. De seneste fund fra forskerne i Würzburg kan bidrage til at fjerne manglerne.
En undervurderet aminosyre
"Vi har opdaget, at web -edderkopper gør brug af en bestemt aminosyre, kaldet methionin, at forbinde silkeproteiner tæt på en tidligere ukendt måde, "Neuweiler skitserer det centrale resultat af undersøgelsen. På baggrunden:Alt liv er baseret på proteiner. Naturen trækker på et begrænset sæt af 20 forskellige aminosyrer for at opbygge alle proteiner, som kritisk deltager i næsten enhver opgave for en levende organisme. Efter at være blevet syntetiseret som lineære kæder af aminosyrer, de fleste proteiner foldes i stærkt ordnede, tredimensionelle strukturer.
Naturlige aminosyrer kan groft opdeles i to grupper baseret på egenskaberne af deres sidekæder. Såkaldte hydrofobe sidekæder har en lav opløselighed i vand. De er ofte placeret i kernen af et protein og stabiliserer den foldede tilstand. Hydrofil, eller vandopløseligt, sidekæder har en tendens til at være på overfladen af proteinet, hvor de er ansvarlige for en næsten ubegrænset række funktioner. Methionin tilhører gruppen af hydrofobe aminosyrer. Men det er sjældent i de fleste proteiner. "Til dato, molekylærbiologer og proteinforskere har kun været lidt opmærksom på denne aminosyre. I proteiner menes sidekæden af methionin at have ringe funktionel betydning, "Siger Neuweiler.
Betydelig forbedring af funktionen
Denne opfattelse kan ændre sig nu. Sidekæden af methionin er kendt for at være usædvanligt fleksibel i forhold til sidekæderne for de andre 19 naturlige aminosyrer. Neuweiler og hans team kunne nu vise, at edderkopper udnytter denne ejendom ved at placere et stort antal methionin i kernen af de aminoterminale domæner i deres silkeproteiner. Her overfører aminosyren sin fleksibilitet til hele strukturen af domænet, hvilket gør det sejt.
Traditionelt betragtes proteiner som stive kroppe. Nyere forskning, imidlertid, fremhæver betydningen af proteindynamik for deres funktion. "Som en formbar nøgle, der tilpasser sin form til låsen, silkeproteinernes domæner ændrer deres form for tæt at forbinde med hinanden, "Neuweiler beskriver processen. Denne effekt øger bindingsstyrken mellem de terminale domæner væsentligt. Methionin i den hydrofobe kerne af et protein gør strukturen umulig, som dramatisk kan forbedre funktionen.
Fra grundforskning til anvendt videnskab
Dr. Neuweiler og hans kolleger udfører grundforskning i deres laboratorier. "Vores arbejde sigter mod at yde grundlæggende bidrag til forståelsen af forholdet mellem struktur, dynamik og funktion af proteiner, "siger forskeren. Samtidig, han forventer, at disse nye fund vil få konsekvenser inden for design og udvikling af nye proteiner såvel som i materialevidenskab.
Han mener, at det er tænkeligt at inkorporere methionin i kernen af proteiner, som web edderkopper gør, for at forbedre deres funktioner eller endda oprette nye funktioner. Efter Neuweilers opfattelse, materialevidenskab vil sandsynligvis drage fordel af opdagelsen af, at methionin i silkeproteiner driver tætte interaktioner i edderkoppesilke. Ved kunstigt at ændre methioninindholdet i silkeproteindomæner, det kan være muligt at kontrollere de mekaniske egenskaber af det syntetiske materiale.
Neuweiler og hans team planlægger at foretage sammenlignende undersøgelser af metionins virkning i silkeproteiner fra andre edderkoppearter og silkekirtler. I øvrigt, de ønsker at inkorporere methionin i proteiner fra andre organismer for at ændre og muligvis forbedre deres funktioner.
 Varme artikler
Varme artikler
-
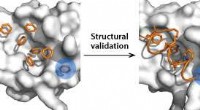 Benzen-baserede prober fremhæver to skjulte bindingssteder på et anticancer-lægemiddelmålBindingslommedetektion ved hjælp af benzenmolekyler som prober (venstre) og strukturel validering ved brug af hæftede peptider (højre). Kredit:Y. S. Tan et al. I jagten på nye kræftbehandlinger, A
Benzen-baserede prober fremhæver to skjulte bindingssteder på et anticancer-lægemiddelmålBindingslommedetektion ved hjælp af benzenmolekyler som prober (venstre) og strukturel validering ved brug af hæftede peptider (højre). Kredit:Y. S. Tan et al. I jagten på nye kræftbehandlinger, A -
 Radikal afsaltningstilgang kan forstyrre vandindustrienIllustration, der beskriver ferskvandsproduktion fra hypersalinlake ved ekstraktion af temperatursvingende opløsningsmidler. Kredit:Chanhee Boo/Columbia Engineering Hypersalin saltlage - vand, der
Radikal afsaltningstilgang kan forstyrre vandindustrienIllustration, der beskriver ferskvandsproduktion fra hypersalinlake ved ekstraktion af temperatursvingende opløsningsmidler. Kredit:Chanhee Boo/Columbia Engineering Hypersalin saltlage - vand, der -
 Forskere undersøger materialeegenskaber for længerevarende, mere effektive solcellerTidligere postdoktor ved Florida State University, Sarah Wieghold, venstre, og FSU adjunkt i kemi og biokemi Lea Nienhaus. Deres forskning hjælper med at forstå de grundlæggende processer i et materia
Forskere undersøger materialeegenskaber for længerevarende, mere effektive solcellerTidligere postdoktor ved Florida State University, Sarah Wieghold, venstre, og FSU adjunkt i kemi og biokemi Lea Nienhaus. Deres forskning hjælper med at forstå de grundlæggende processer i et materia -
 Sådan bestemmes mol SoluteI en opløsning er opløsningen den mindre bestanddel, der opløses i opløsningsmidlet. F.eks. Er salt det opløste i en saltvandopløsning, og isopropanol eller ethanol er det opløste stof i en gnidningsa
Sådan bestemmes mol SoluteI en opløsning er opløsningen den mindre bestanddel, der opløses i opløsningsmidlet. F.eks. Er salt det opløste i en saltvandopløsning, og isopropanol eller ethanol er det opløste stof i en gnidningsa
- Indfangning af konturerne af levende celler med ny nanobilledteknik ved hjælp af grafen
- Spredning af omkostningerne til at transformere sanitet
- Lorena lander i det sydvestlige Mexico som kategori 1 -orkan
- Internationalt hold studerer verdens sidste ukendte store floddelta
- Elektron kryo-mikroskopi:Brug af billig teknologi til at producere billeder i høj opløsning
- Hvad er Marshmallow -testen, og kan dyr bestå den?


