Elektron kryo-mikroskopi:Brug af billig teknologi til at producere billeder i høj opløsning
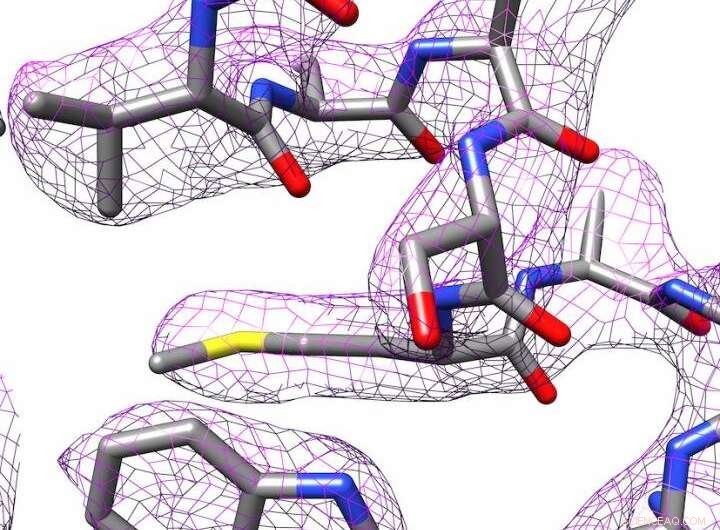
3D-struktur af apoferritin produceret ved elektronkryo-mikroskopi. Kredit:Panagiotis Kastritis
Biokemikere ved Martin Luther University Halle-Wittenberg (MLU) har brugt et standard elektronkryo-mikroskop til at opnå overraskende gode billeder, der er på niveau med dem taget af langt mere sofistikeret udstyr. Det er lykkedes dem at bestemme strukturen af ferritin næsten på atomniveau. Deres resultater blev offentliggjort i tidsskriftet PLOS ET .
Elektron kryo-mikroskopi er blevet stadig vigtigere i de senere år, især i belysning af proteinstrukturer. Udviklerne af den nye teknologi blev tildelt Nobelprisen i kemi i 2017. Tricket:prøverne lynfryses og bombarderes derefter med elektroner. I tilfælde af traditionel elektronmikroskopi, alt vandet ekstraheres først fra prøven. Dette er nødvendigt, fordi undersøgelsen foregår i et vakuum, hvilket betyder, at vand ville fordampe med det samme og gøre billeddannelse umulig.
Imidlertid, fordi vandmolekyler spiller en så vigtig rolle i biomolekyler, især i proteiner, de kan ikke undersøges ved hjælp af traditionel elektronmikroskopi. Proteiner er blandt de vigtigste byggesten i celler og udfører en række forskellige opgaver. Indgående kendskab til deres struktur er nødvendig for at forstå, hvordan de fungerer.
Forskergruppen ledet af Dr. Panagiotis Kastritis, som er gruppeleder ved Center for Innovationskompetence HALOmem og juniorprofessor ved Institut for Biokemi og Bioteknologi ved MLU, erhvervede et avanceret elektronkryomroskop i 2019. "Der er intet andet mikroskop som det i Halle, " siger Kastritis. Den nye Thermo Fisher Glacios 200 kV, finansieret af Forbundsministeriet for Uddannelse og Forskning, er ikke det bedste og dyreste mikroskop af slagsen.
Alligevel, Det lykkedes Kastritis og hans kolleger at bestemme strukturen af jernlagerproteinet apoferritin ned til 2,7 ångströms (Å), med andre ord, næsten ned til det enkelte atom. En ångström er lig med en tiendedel af en nanometer. Det placerer forskergruppen i en lignende liga som afdelinger med langt dyrere udstyr. Apoferritin bruges ofte som et referenceprotein til at bestemme ydeevneniveauerne for tilsvarende mikroskoper.
For nylig, to forskergrupper slog ny rekord med en opløsning på omkring 1,2 Å. "Sådanne værdier kan kun opnås ved hjælp af meget kraftfulde instrumenter, som kun en håndfuld forskningsgrupper verden over har til deres rådighed. Vores metode er designet til mikroskoper fundet i mange laboratorier, " forklarer Kastritis.
Elektron kryo-mikroskoper er meget komplekse enheder. "Selv små fejljusteringer kan gøre billederne ubrugelige, " siger Kastritis. Det er vigtigt at programmere dem rigtigt, og Halle har den tekniske ekspertise til at gøre dette. Men analysen, der udføres, efter at dataene er blevet indsamlet, er lige så vigtig. "Mikroskopet producerer flere tusinde billeder, " forklarer Kastritis.
Billedbehandlingsprogrammer bruges til at skabe en 3D-struktur af molekylet. I samarbejde med professor Milton T. Stubbs fra Institut for Biokemi og Bioteknologi ved MLU, forskerne har udviklet en ny metode til at skabe en højopløsningsmodel af et protein. Stubbs' forskergruppe bruger røntgenkrystallografi, en anden teknik til at bestemme strukturen af proteiner, hvilket kræver at proteinerne krystalliseres. De var i stand til at kombinere en modificeret form for billedanalyseteknik med billederne taget med elektronkryo-mikroskopet. Dette gjorde ladningstilstande og individuelle vandmolekyler synlige.
"Det er en attraktiv metode, " siger Kastritis. I stedet for at have brug for meget dyre mikroskoper, der kræves meget computerkapacitet, som MLU har. Nu, ud over at bruge røntgenkrystallografi, elektronkryo-mikroskopi kan bruges til at producere billeder af proteiner - især dem, der er svære at krystallisere. Dette muliggør samarbejde, både i og uden for universitetet, om strukturel analyse af prøver med medicinsk og bioteknologisk potentiale.
Sidste artikelForskere udvikler ny teknik til produktion af plasmonics-enheder
Næste artikelSpindende kemikalier for hurtigere reaktioner
 Varme artikler
Varme artikler
-
 Hvordan man fortæller, om noget er polært eller ikke-polærtPolaritet beskriver tendensen for et stof til at have en molekylær dipol, eller en positiv og negativt ladet ende. Polære molekyler er lavet af elementer med forskellige elektronegativiteter eller ele
Hvordan man fortæller, om noget er polært eller ikke-polærtPolaritet beskriver tendensen for et stof til at have en molekylær dipol, eller en positiv og negativt ladet ende. Polære molekyler er lavet af elementer med forskellige elektronegativiteter eller ele -
 Fremstilling af bæredygtige polymerer fra duftende molekylerKredit:CC0 Public Domain En måde at fremstille organiske polymerer på fra de duftende molekyler i nåletræer og frugttræer er blevet udviklet af forskere ved University of Birmingham. Teknikken, u
Fremstilling af bæredygtige polymerer fra duftende molekylerKredit:CC0 Public Domain En måde at fremstille organiske polymerer på fra de duftende molekyler i nåletræer og frugttræer er blevet udviklet af forskere ved University of Birmingham. Teknikken, u -
 Kulstofprikker gør calcium lettere at sporeIllustration af Ca2+ -detektering ved hjælp af EGTA-modificerede cder. Kredit:SIBET På hospitaler, læger råder ofte patienter til at tage calciumtilskud. Men kommer calcium ind i de celler, der ha
Kulstofprikker gør calcium lettere at sporeIllustration af Ca2+ -detektering ved hjælp af EGTA-modificerede cder. Kredit:SIBET På hospitaler, læger råder ofte patienter til at tage calciumtilskud. Men kommer calcium ind i de celler, der ha -
 Gennembrud af kemisk syntese lover fremtiden for antibiotikaKredit:CC0 Public Domain University of Colorado Boulder kemiforskere har udviklet en ny måde at syntetisere og optimere en naturligt forekommende antibiotisk forbindelse, der en dag kan bruges til
Gennembrud af kemisk syntese lover fremtiden for antibiotikaKredit:CC0 Public Domain University of Colorado Boulder kemiforskere har udviklet en ny måde at syntetisere og optimere en naturligt forekommende antibiotisk forbindelse, der en dag kan bruges til
- 48, 000 år gamle pilespidser afslører tidlig menneskelig innovation i Sri Lankas regnskov
- Hvorfor foretrækker en Yellowstone -mikroorganisme magre rationer frem for rige?
- Hvordan maskinlæring hjalp med at udvikle en ny algoritme, der kunne tilføre liv til broer
- Meget forventet atomeksperiment i gang
- Sådan laver du en glødelampe med et batteri
- Forskere hjælper med at kortlægge og spejde efter hydrotermiske ventilationsåbninger i Gulf of Ca…


