Frugtfluemodel identificerer nøgleregulatorer bag organudvikling
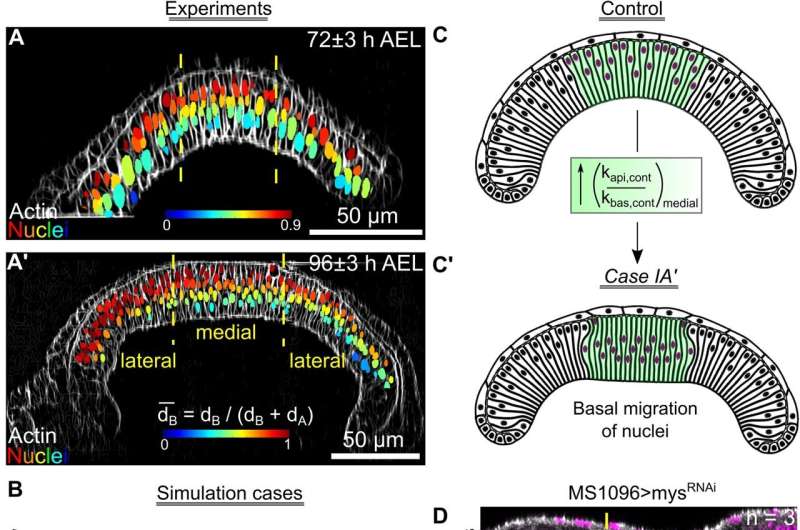
En ny beregningsmodel, der simulerer udvikling af frugtfluevinger, har gjort det muligt for forskere at identificere tidligere skjulte mekanismer bag organgenerering.
Fordi organer udvikler sig på bemærkelsesværdigt lignende måder i frugtfluer og mennesker, kan biologiske indsigter fra denne model bruges til at informere om diagnosticering og behandling af menneskelige sygdomme såsom cancer, Alzheimers og medfødte genetiske fødselsdefekter.
Jeremiah Zartman, lektor i kemisk og biomolekylær ingeniørvidenskab ved University of Notre Dame, arbejdede sammen med et multidisciplinært forskerhold, der omfattede samarbejdspartnere fra University of California, Riverside, for at udvikle en frugtfluemodel til at omvendt konstruere de mekanismer, der genererer organvæv.
Holdets resultater, som giver en dybere forståelse af de kemiske og mekaniske håndtag, der regulerer organcellernes størrelse og form, er blevet offentliggjort i Nature Communications .
"Vi forsøger at simulere et organ i computeren - effektivt at skabe en digital tvilling af det organ," sagde Zartman. "Vi tager de forskellige celler og dele af celler for at se, om vi kan forudsige, hvordan de vil interagere med hinanden."
Organer udvikler sig som reaktion på, hvad Zartman kalder en "symfoni" af signaler. Forskernes frugtfluemodel integrerer de talrige signaler, der orkestrerer cellebevægelse, sammentrækning, adhæsion og spredning. Den inkorporerer også de mekaniske, kemiske og strukturelle egenskaber af cellekomponenter og redegør for, hvordan disse egenskaber ændrer sig over tid og på forskellige steder.
Både modellen og hans laboratoriums eksperimentelle resultater viste, at der var to adskilte klasser af kemiske signalveje eller sekvenser af signaler, der producerer enten buet eller fladt væv – hvilket identificerer fleksibiliteten og tilpasningsevnen ved at generere et organ med en specificeret form.
Celler, der modtog signaler fra insulin, førte til en stigning i vævets krumning, mens celler, der modtog input fra to andre nøglevækstregulatorer, gjorde væv fladt. Forskerne opdagede, at disse vækstregulatorer også manipulerede cellens indre ramme, eller cytoskelet, for yderligere at forme cellestørrelse og form.
Zartman-gruppens overordnede mål er at identificere, i hvor høj grad de biologiske regler, der er hentet fra simulerede flueorganundersøgelser, deles med systemer så forskellige som planter, fisk og mennesker.
"Vores mål for fremtiden er at udvikle et digitalt prototypeorgan, der tackler et grundlæggende spørgsmål inden for biologi - hvordan genererer celler funktionelle organer?" sagde Zartman.
Flere oplysninger: Nilay Kumar et al., Balancering af konkurrerende virkninger af vævsvækst og cytoskeletregulering under udvikling af Drosophila vingediske, Nature Communications (2024). DOI:10.1038/s41467-024-46698-7
Journaloplysninger: Nature Communications
Leveret af University of Notre Dame
 Varme artikler
Varme artikler
-
 Kan svampe hjælpe græsset i Texas med at klare klimaændringer?Fra venstre mod højre flækker Rice University-studerende Ali Campbell græsstænglen og samler et tyndt lag væv, som senere vil blive undersøgt under et mikroskop for tilstedeværelsen af symbiotiske s
Kan svampe hjælpe græsset i Texas med at klare klimaændringer?Fra venstre mod højre flækker Rice University-studerende Ali Campbell græsstænglen og samler et tyndt lag væv, som senere vil blive undersøgt under et mikroskop for tilstedeværelsen af symbiotiske s -
 Hvad ligger under:Rødder som drivere af det sydafrikanske landskabsmønsterDen endemiske art Cyrtanthus ventricosus dukker op efter brand i de stærkt næringssultne jorde i Fynbos biome (Jonkershoek Nature Reserve). Kredit:Mingzhen Lu Vi tænker typisk på planter, der strit
Hvad ligger under:Rødder som drivere af det sydafrikanske landskabsmønsterDen endemiske art Cyrtanthus ventricosus dukker op efter brand i de stærkt næringssultne jorde i Fynbos biome (Jonkershoek Nature Reserve). Kredit:Mingzhen Lu Vi tænker typisk på planter, der strit -
 Forstå sproget i mobilkommunikationI flercellede organismer, celler skal adressere beskeder til specifikke andre celletyper. For at gøre det, celler bruger et sæt lignende, men ikke identisk, signalerende proteiner, eller ligander. Hve
Forstå sproget i mobilkommunikationI flercellede organismer, celler skal adressere beskeder til specifikke andre celletyper. For at gøre det, celler bruger et sæt lignende, men ikke identisk, signalerende proteiner, eller ligander. Hve -
 Hvordan afgrøder året rundt kan reducere landbrugsforureningen i Mississippi-flodenKredit:Pixabay/CC0 Public Domain Don Wyses mark med vinterbyg plejede at være for det meste tom om foråret. For otte år siden ville blot en tiendedel af kornet overleve vinteren i denne forsøgsmar
Hvordan afgrøder året rundt kan reducere landbrugsforureningen i Mississippi-flodenKredit:Pixabay/CC0 Public Domain Don Wyses mark med vinterbyg plejede at være for det meste tom om foråret. For otte år siden ville blot en tiendedel af kornet overleve vinteren i denne forsøgsmar
- Kan katte og prærieulve eksistere side om side?
- Undersøgelse viser potentiale for at genoplive forladt kræftmedicin ved levering af nanopartikler
- NASA vender teknologien tilbage mod Jorden for at fokusere på klimaændringer
- Perseid Meteor -brusebadet er tilbage - Her er hvad du behøver at vide
- Brug af grafen til at oprette kvantebits
- Nanoskala billeddannelse af stamme ved hjælp af X-ray Bragg projektion ptychography


