Selvom metaller og salte har lignende gitterstrukturer, fremstiller gode materialer til elektriske ledninger Hvorfor brugt i stedet?
1. Gratis elektroner:
* Metaller: Metaller har en unik struktur, hvor deres yderste elektroner er løst bundet til atomerne. Disse elektroner er i det væsentlige frie til at bevæge sig gennem metalgitteret. Når et elektrisk felt påføres, flyder disse frie elektroner, hvilket skaber en elektrisk strøm.
* salte: Salt er på den anden side sammensat af ioner (ladede partikler). Disse ioner holdes i en stiv gitterstruktur af stærke elektrostatiske kræfter. Mens de kan udføre elektricitet, når de opløses i vand (danner elektrolytter), udfører de ikke elektricitet i deres faste tilstand på grund af deres ioner faste karakter.
2. Konduktivitet:
* Metaller: Metaller er fremragende ledere af elektricitet på grund af overflod af frie elektroner. Deres ledningsevne er generelt meget højere end Salts.
* salte: Mens salte kan udføre elektricitet i opløsning, er deres ledningsevne signifikant lavere end for metaller.
3. Praktiske overvejelser:
* Holdbarhed: Mange metaller er stærke, duktile (kan trækkes ind i ledninger) og er modstandsdygtige over for korrosion, hvilket gør dem ideelle til langvarige ledningsanvendelser.
* Omkostninger: Metaller, især kobber og aluminium, er relativt billige at fremstille og er bredt tilgængelige.
Kortfattet:
Mens både metaller og salte har gitterstrukturer, gør tilstedeværelsen af frie elektroner i metaller dem langt overlegne ledere af elektricitet sammenlignet med salte. Dette kombineret med deres holdbarhed og omkostningseffektivitet gør metaller til det foretrukne valg til elektriske ledninger.
 Varme artikler
Varme artikler
-
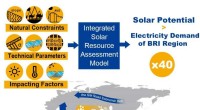 Solenergi kan gøre Bælt- og Vejinitiativet grøntDette visuelle abstrakt opsummerer hvordan med et enormt og ubalanceret regionalt solpotentiale, samarbejde og sammenkobling ved hjælp af BRI giver mulighed for at afkoble fremtidig økonomisk vækst fr
Solenergi kan gøre Bælt- og Vejinitiativet grøntDette visuelle abstrakt opsummerer hvordan med et enormt og ubalanceret regionalt solpotentiale, samarbejde og sammenkobling ved hjælp af BRI giver mulighed for at afkoble fremtidig økonomisk vækst fr -
 Lovgivere:Boeing ønskede at vente 3 år med at rette Max-fejlenKredit:CC0 Public Domain To vigtige lovgivere sagde fredag, at Boeing planlagde at udsætte reparationen af en ikke-fungerende sikkerhedsalarm på sit 737 Max-fly i tre år og fremskyndede processe
Lovgivere:Boeing ønskede at vente 3 år med at rette Max-fejlenKredit:CC0 Public Domain To vigtige lovgivere sagde fredag, at Boeing planlagde at udsætte reparationen af en ikke-fungerende sikkerhedsalarm på sit 737 Max-fly i tre år og fremskyndede processe -
 Ny passagerscanner bruger rumteknologi til at fremskynde lufthavnssikkerhedenKredit:Cardiff University En superfølsom passagerscanner, der afslører skjulte sikkerhedstrusler, testes i Cardiff Airport i Storbritannien. Gennemgangsscanneren, som bruger rumteknologi til at f
Ny passagerscanner bruger rumteknologi til at fremskynde lufthavnssikkerhedenKredit:Cardiff University En superfølsom passagerscanner, der afslører skjulte sikkerhedstrusler, testes i Cardiff Airport i Storbritannien. Gennemgangsscanneren, som bruger rumteknologi til at f -
 Hvordan tilfældigt bevægende elektroner kan forbedre cybersikkerhedenBilledet af den fremstillede elektroniske chip, der genererer det tilfældige tal. Chippen indlæses i måleopsætningen, hvor tilfældigheden af elektronindfangningen/de-trappingen omdannes til binære u
Hvordan tilfældigt bevægende elektroner kan forbedre cybersikkerhedenBilledet af den fremstillede elektroniske chip, der genererer det tilfældige tal. Chippen indlæses i måleopsætningen, hvor tilfældigheden af elektronindfangningen/de-trappingen omdannes til binære u
- Hvilket har et lavere kogepunkt A alkohol B vand C olie eller D -is?
- Samme egenskaber, lavere omkostninger-Kobberbaseret alternativ til næste generations elektronik
- Sukker forstyrrer mikrobiom, eliminerer beskyttelse mod fedme og diabetes
- Hvordan reproducerer jordmaskene?
- Med en billig Pandigital tablet får du hvad du betaler for
- Opsendelse af rumstation hylder Hidden Figures-matematiker


