Forskere opnår den ultimative opløsningsgrænse i fluorescensmikroskopi
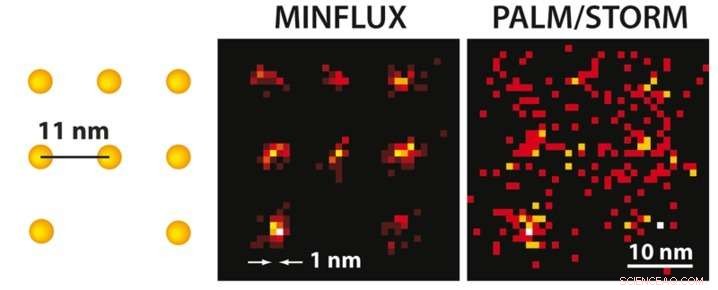
Med MINFLUX mikroskopi kan man, for første gang, adskilte molekyler optisk, som kun er få nanometer fra hinanden. Til venstre, en skematisk oversigt over de fluorescerende molekyler præsenteres. Hvorimod den ultrahøje opløsning PALM/STORM-mikroskopi ved samme molekylære lysstyrke (til højre) leverer et diffust billede af molekylerne (her i en simulering under ideelle tekniske forhold), positionen af de enkelte molekyler kan let skelnes med den praktisk realiserede MINFLUX (midten). Kredit:MPI f. Biofysisk kemi/ K. Gwosch
Det er lysmikroskopiens hellige gral:forbedring af denne metodes opløsningsstyrke, så man individuelt kan skelne molekyler, der er meget tæt på hinanden. Forskere omkring nobelpristageren Stefan Hell ved Max Planck Institute for Biophysical Chemistry i Göttingen har nu opnået det, der længe blev anset for umuligt - de har udviklet et nyt fluorescensmikroskop, kaldet MINFLUX, tillader, for første gang, at optisk adskille molekyler, som kun er nanometer (en milliontedel af en millimeter) fra hinanden. Dette mikroskop er mere end 100 gange skarpere end konventionel lysmikroskopi og overgår selv de bedste superopløselige lysmikroskopimetoder til dato, nemlig STED udviklet af Helvede og PALM/STORM beskrevet af nobelpristageren Eric Betzig, med op til 20 gange. Til MINFLUX, Helvede brugte fordelene ved STED og PALM/STORM i et helt nyt koncept. Dette gennembrud åbner nye muligheder for forskere for at undersøge, hvordan livet fungerer på molekylært niveau.
"Vi har rutinemæssigt opnået resolutioner af et nanometer med MINFLUX, som er individuelle molekylers diameter - den ultimative grænse for, hvad der er muligt i fluorescensmikroskopi, "forklarer Helvede, Direktør ved Max Planck Institute for Biophysical Chemistry. "Jeg er overbevist om, at MINFLUX -mikroskoper har potentiale til at blive et af de mest fundamentale værktøjer inden for cellebiologi. Med dette koncept vil det være muligt at kortlægge celler i molekylær detalje og observere de hurtige processer i deres indre i realtid. Dette kunne revolutionere vores viden om de molekylære processer, der forekommer i levende celler. "
Göttingen -fysikeren, der også arbejder på Max Planck Institute for Medical Research og det tyske kræftforskningscenter i Heidelberg, har længe været overbevist om, at fluorescensmikroskopi -opløsning kan øges ned til dimensionen af individuelle molekyler - med klassisk brug af fokuseret lys og konventionelle linser.
Faktisk, fysikeren Ernst Abbe havde formuleret i 1873, at opløsningen af lysmikroskoper er begrænset til halvdelen af lysets bølgelængde, hvilket er omkring 200 nanometer. Mere end 100 år senere, denne Abbe -grænse er stadig gyldig. Imidlertid, Helvede var den første til at vise, at denne grænse kan overvindes med STED -mikroskopi, som han undfangede i 1994 og etablerede eksperimentelt fem år senere.
STED samt PALM/STORM, udviklet et par år senere, i praksis opnå en separationsskarphed på omkring 20 til 30 nanometer - cirka ti gange bedre end Abbe -grænsen. Til udvikling af disse ultrahøj opløsning lysmikroskopi teknikker, Hell og Betzig blev sammen med William E. Moerner tildelt Nobelprisen i kemi i 2014.
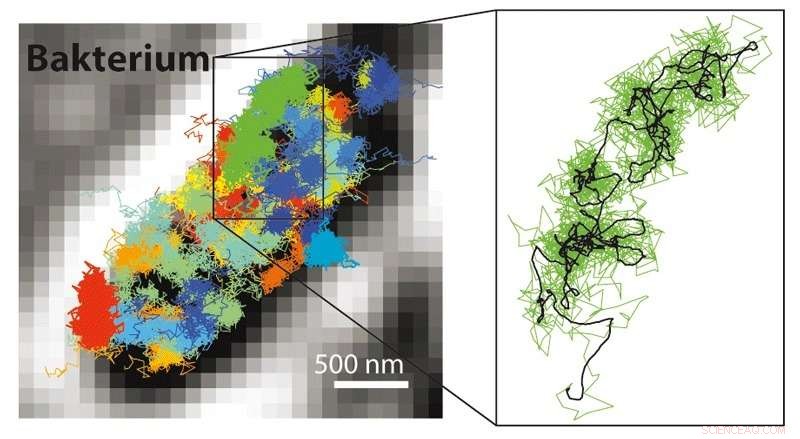
Med MINFLUX er det muligt at følge mange meget hurtigere bevægelser end muligt med STED- eller PALM/STORM -mikroskopi. Det er derfor muligt at gøre bevægelser af fluorescensmærkede molekyler synlige i en levende celle. Til venstre:Bevægelsesmønster af 30S ribosomer (dele af proteinfabrikker, farvet) i en E. coli-bakterie (sort-hvid). Til højre:Bevægelsesmønster for et enkelt 30S ribosom (grønt) vist forstørret. Kredit:MPI f. Biofysisk kemi/ Y. Eilers
Fordele ved STED og PALM/STORM kombineret
Både STED og PALM/STORM adskiller nabofluorescerende molekyler ved at tænde og slukke dem efter hinanden, så de udsender fluorescens sekventielt. Imidlertid, metoderne adskiller sig på et væsentligt punkt:STED-mikroskopi bruger en doughnut-formet laserstråle til at slukke molekylær fluorescens på et fast sted i prøven, dvs. overalt i fokusområdet undtagen i donutcentret. Fordelen er, at donutstrålen definerer præcist på hvilket tidspunkt i rummet det tilsvarende glødende molekyle er placeret. Ulempen er, at laserstrålen i praksis ikke er stærk nok til at begrænse emissionen til et enkelt molekyle i donutcentret. I tilfælde af PALM/STORM, på den anden side, til- og frakobling sker tilfældigt og på enkeltmolekylniveau. Fordelen her er, at man allerede arbejder på enkeltmolekylniveau, men en ulempe er, at man ikke kender de nøjagtige molekylpositioner i rummet. Positionerne skal findes ved at indsamle så mange fluorescensfotoner som muligt på et kamera; mere end 50, 000 detekterede fotoner er nødvendige for at opnå en opløsning på mindre end 10 nanometer. I praksis, man kan derfor ikke rutinemæssigt opnå molekylær (en nanometer) opløsning.
Helvede havde ideen om entydigt at kombinere styrkerne ved begge metoder i et nyt koncept. "Denne opgave var alt andet end triviel. Men mine kolleger Francisco Balzarotti, Yvan Eilers, og Klaus Gwosch har gjort et vidunderligt stykke arbejde med at implementere denne idé eksperimentelt med mig. "Deres nye teknik, kaldet MINFLUX (MINIMAL emission FLUXes), introduceres nu af Helvede sammen med de tre yngre forskere som første forfattere inden for videnskab.
MINFLUX, som PALM/STORM, slår enkelte molekyler tilfældigt til og fra. Imidlertid, på samme tid, deres nøjagtige position bestemmes med en doughnut-formet laserstråle som i STED. I modsætning til STED, donutstrålen her ophidser fluorescensen. Hvis molekylet er på ringen, det vil lyse; hvis det er præcis i det mørke centrum, den lyser ikke, men man har fundet sin nøjagtige position. Balzarotti udviklede en smart algoritme, så denne position kunne placeres meget hurtigt og med høj præcision. "Med denne algoritme var det muligt at udnytte potentialet i donut -excitationsstrålen, "forklarer den unge videnskabsmand. Gwosch, hvem opnåede de molekylæropløste billeder, tilføjer "Det var en utrolig følelse, da vi, for første gang, var i stand til at skelne detaljer med MINFLUX på skalaen på et par nanometer. "
100 gange bedre opløsning
Ud over den molekylære opløsning, kombinationen af STED og PALM/STORM giver en ekstra stor fordel:"MINFLUX er meget hurtigere i sammenligning. Da det fungerer med en donut laserstråle, det kræver meget lavere lyssignal, dvs. færre fluorescensfotoner, pr. molekyle sammenlignet med PALM/STORM for at opnå den ultimative opløsning, "Helvede siger. Allerede med STED kunne man optage videoer i realtid inde fra levende celler. Men nu var det muligt at spore molekylers bevægelse i en celle med en 100 gange bedre tidsopløsning, som Eilers understreger. Det lykkedes ham at filme bevægelsen af molekyler i en levende E. coli -bakterie med MINFLUX for første gang, med en hidtil uset rumlig-tidsmæssig opløsning. "Hvad angår hastighed, vi har ikke udnyttet mulighederne optimalt med MINFLUX, "Siger Eilers. Forskerne er overbeviste om, at selv ekstremt hurtigt forekommende ændringer i levende celler kan undersøges i fremtiden, som f.eks. bevægelse af cellulære nanomaskiner eller foldning af proteiner.
 Varme artikler
Varme artikler
-
 En ny effekt inden for elektromagnetisme opdaget - 150 år senereFig. (A) camelback -feltindeslutningseffekt i parallel dipol line (PDL) system. (b) IBM PDL magnetfældesystem. En grafitstang bliver fanget og svæver konstant uden indgangseffekt. (d) Medlem af The Ne
En ny effekt inden for elektromagnetisme opdaget - 150 år senereFig. (A) camelback -feltindeslutningseffekt i parallel dipol line (PDL) system. (b) IBM PDL magnetfældesystem. En grafitstang bliver fanget og svæver konstant uden indgangseffekt. (d) Medlem af The Ne -
 Mekanikken ved kavitationsinduceret skade giver en bedre forståelse af traumatiske hjerneskaderKonfokalt billede af neuroner før og efter kavitationsskade blev induceret. Kredit:Estrada et al. Traumatisk hjerneskade (TBI) er en stort set tavs epidemi, der rammer omkring to millioner mennesk
Mekanikken ved kavitationsinduceret skade giver en bedre forståelse af traumatiske hjerneskaderKonfokalt billede af neuroner før og efter kavitationsskade blev induceret. Kredit:Estrada et al. Traumatisk hjerneskade (TBI) er en stort set tavs epidemi, der rammer omkring to millioner mennesk -
 Forskere får gennembrud i solcellematerialerFra venstre, Pan Adhikari, Lawrence Coleman og Kanishka Kobbekaduwa justerer den ultrahurtige laser i Institut for Fysik og Astronomiens UPQD -laboratorium. Kredit:Clemson University Ved at bruge
Forskere får gennembrud i solcellematerialerFra venstre, Pan Adhikari, Lawrence Coleman og Kanishka Kobbekaduwa justerer den ultrahurtige laser i Institut for Fysik og Astronomiens UPQD -laboratorium. Kredit:Clemson University Ved at bruge -
 At se objekter i bevægelse rundt om hjørnerDe optagne målinger afspilles som en video, viser lys, der sprøjter hen over væggen, når det spreder sig tilbage fra de skjulte genstande. Kredit:David Lindell David Lindell, en kandidatstuderende
At se objekter i bevægelse rundt om hjørnerDe optagne målinger afspilles som en video, viser lys, der sprøjter hen over væggen, når det spreder sig tilbage fra de skjulte genstande. Kredit:David Lindell David Lindell, en kandidatstuderende
- Hvordan man fortæller om en kardinal fugl er mand eller kvinde
- En nano-transistor vurderer dit helbred via sved
- De lyse måder, skovene påvirker deres miljø på
- Tager ansvaret:Forskere går sammen om at lave bedre batterier
- En bæredygtig ny løsning til aldring, korroderende infrastruktur
- Topologi beskytter lysudbredelse i fotonisk krystal


