En ny computermodel undersøger, hvordan proteiner styres på afstand
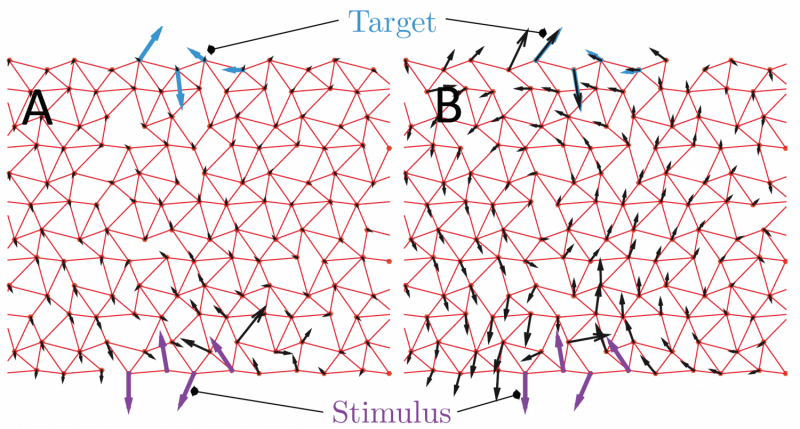
En illustration af den nye allosteriske model udviklet i denne undersøgelse. Kredit:Matthieu Wyart/EPFL
EPFL-forskere har skabt en ny computermodel, der kan hjælpe med et bedre design af allosteriske lægemidler, som styrer proteiner "på afstand".
Enzymer er store proteiner, der er involveret i stort set alle biologiske processer, faciliterer en lang række biokemiske reaktioner i vores celler. På grund af dette, en af de største indsatser inden for lægemiddeldesign i dag har til formål at kontrollere enzymer uden at forstyrre deres såkaldte aktive steder - den del af enzymet, hvor den biokemiske reaktion finder sted. Denne "på afstand"-tilgang kaldes "allosterisk regulering", og forudsigelse af allosteriske veje for enzymer og andre proteiner har samlet stor interesse. Forskere fra EPFL, med kolleger i USA og Brasilien, har nu udviklet et nyt matematisk værktøj, der tillader mere effektive allosteriske forudsigelser. Værket er udgivet i PNAS .
Allosteriske lægemidler
Allosterisk regulering er en grundlæggende molekylær mekanisme, der modulerer adskillige celleprocesser, finjustere dem og gøre dem mere effektive. De fleste proteiner indeholder dele i deres struktur væk fra deres aktive sted, som kan målrettes for at påvirke deres adfærd "på afstand". Når et allosterisk modulatormolekyle - hvad enten det er naturligt eller syntetisk - binder et sådant sted, det ændrer 3D-strukturen af proteinet, derved påvirke dens funktion.
Hovedårsagen til, at allosteriske steder er af sådan interesse for lægemiddeldesign, er, at de kan bruges til at hæmme eller forbedre aktiviteten af et protein, f.eks. bindingsstyrken af et enzym eller en receptor. For eksempel, diazepam (Valium) virker på et allosterisk sted af GABAA-receptoren i hjernen, og øger dens bindingsevne. Dens modgift, flumazenil (Lanexat), handler på samme sted, men i stedet hæmmer receptoren.
Generelt sagt, et allosterisk lægemiddel vil også blive brugt i en forholdsvis lavere dosis end et lægemiddel, der virker direkte på proteinets aktive sted, giver dermed mere effektive behandlinger med færre bivirkninger.
Udvikling af en allosterisk model
På trods af vigtigheden af allosteriske processer, vi forstår stadig ikke helt, hvordan et molekyle, der binder sig til en fjern og tilsyneladende uvigtig del af et stort protein, kan ændre dets funktion så dramatisk. Nøglen ligger i proteinets overordnede arkitektur, som bestemmer, hvilke slags 3D-ændringer en allosterisk effekt vil have.
Laboratoriet hos Matthieu Wyart ved EPFL søgte at besvare flere spørgsmål vedrørende vores nuværende forståelse af allosteriske arkitekturer. Forskere klassificerer disse i to typer:hængsler, som forårsager sakse-lignende 3D-ændringer, og klippe, som involverer to fly, der bevæger sig side om side. På trods af at være klar mekanisk, de to modeller fanger ikke alle tilfælde af allosteriske effekter, hvor visse proteiner ikke kan klassificeres som havende hverken hængsel- eller forskydningsarkitektur.
Forskerne udforskede alternative allosteriske arkitekturer. Specifikt, de så på strukturen af proteiner som tilfældigt pakkede kugler, der kan udvikle sig til at udføre en given funktion. Når en sfære bevæger sig en bestemt vej, denne model kan hjælpe forskere med at spore dens strukturelle indvirkning på hele proteinet.
Ved at bruge denne tilgang, forskerne behandlede flere spørgsmål, som konventionelle modeller ikke besvarer tilfredsstillende. Hvilke typer 3D "arkitektur" er modtagelige for allosteriske effekter? Hvor mange funktionelle proteiner med en lignende arkitektur er der tale om? Hvordan kan disse modelleres og udvikles i en computer for at tilbyde forudsigelser for lægemiddeldesign?
Ved at bruge teori og computerkraft, teamet udviklede en ny model, der kan forudsige antallet af løsninger, deres 3D-arkitektur og hvordan de to forholder sig til hinanden. Hver løsning kan endda printes i en 3D-printer for at skabe en fysisk model.
Modellen foreslår en ny hypotese for allosteriske arkitekturer, introducerer konceptet om, at visse regioner i proteinet kan fungere som løftestænger. Disse løftestænger forstærker responsen induceret ved at binde en ligand og tillader handling på afstand. Denne arkitektur er et alternativ til de tidligere anerkendte hængsel- og forskydningsdesign. Den beregningsmæssige tilgang kan også bruges til at studere forholdet mellem co-evolution, mekanik, og funktion, og samtidig være åben for mange udvidelser i fremtiden.
 Varme artikler
Varme artikler
-
 Tilbageaktion observeret for første gang i sort hul-simulering i vandtankLaboratorieeksperiment ved hjælp af vandtanksimulering for at demonstrere tilbagereaktion. Kredit:University of Nottingham Forskere har afsløret ny indsigt i sorte hullers adfærd med forskning, de
Tilbageaktion observeret for første gang i sort hul-simulering i vandtankLaboratorieeksperiment ved hjælp af vandtanksimulering for at demonstrere tilbagereaktion. Kredit:University of Nottingham Forskere har afsløret ny indsigt i sorte hullers adfærd med forskning, de -
 Strømlining af masseproduktion af printbar elektronikEn hukommelsestestanordning på en polyimidfolie. Kredit:Huber et al. Hukommelsesenheder - som en delmængde af elektroniske funktioner, der inkluderer logik, sensorer og skærme – har gennemgået en
Strømlining af masseproduktion af printbar elektronikEn hukommelsestestanordning på en polyimidfolie. Kredit:Huber et al. Hukommelsesenheder - som en delmængde af elektroniske funktioner, der inkluderer logik, sensorer og skærme – har gennemgået en -
 DUNE-eksperimentet kan føre til nye opdagelser om solneutrinoerEn figur, der opsummerer hovedresultatet af forskernes beregning. Venstre:Akserne i dette plot henviser til de oscillationsparametre, der er relevante for solneutrinooscillationer. Hele det farvede om
DUNE-eksperimentet kan føre til nye opdagelser om solneutrinoerEn figur, der opsummerer hovedresultatet af forskernes beregning. Venstre:Akserne i dette plot henviser til de oscillationsparametre, der er relevante for solneutrinooscillationer. Hele det farvede om -
 Billedværktøj under udvikling afslører skjulte detonatorer - og deres ladningSandia National Laboratories forskere, fra venstre, Yuan-Yu Jau, George Burns, Justin Christensen og Ed Bielejec planlægger at teste en fremtidig neutrongenerator til et elektrisk felt billeddannelses
Billedværktøj under udvikling afslører skjulte detonatorer - og deres ladningSandia National Laboratories forskere, fra venstre, Yuan-Yu Jau, George Burns, Justin Christensen og Ed Bielejec planlægger at teste en fremtidig neutrongenerator til et elektrisk felt billeddannelses
- Sjælden flaske skotsk whisky henter rekordpris
- Genbrugsbeton kan være en bæredygtig måde at holde murbrokkerne væk fra lossepladser
- Skoleprojekter om naturressourcer
- Hvor meget strøm forbruger verden?
- Prisoptimeringsmetode til at øge online detailhandlers omsætning, markedsandel, og overskud
- Nedbrydning af økosystemet


