Strækproteiner med magnetisk pincet
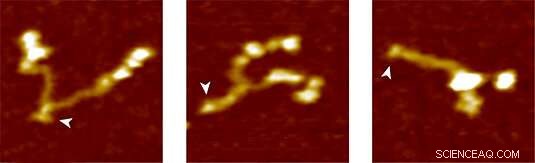
Von Willebrand Factor protein:helt åbent (venstre), delvist lukket og helt lukket (højre). Kredit:Lipfert Group
Fysikere på LMU har udviklet en meget følsom metode til måling af den mekaniske stabilitet af proteinkonformationer, og brugte den til at overvåge de tidlige trin i dannelsen af blodpropper.
Som de centrale formidlere af cellefunktion i biologiske organismer, proteiner er involveret i udførelsen af stort set alle cellulære processer. De giver det interne stillads, der giver celler deres form, og sætte celler i stand til dynamisk at ændre deres morfologi. De transporterer substrater frem og tilbage på tværs af membraner, og de katalyserer de fleste af de kemiske reaktioner, der finder sted i celler. I løbet af disse opgaver udsættes mange proteiner for ydre kræfter. Ja, nogle "mekanosensitive" proteiner måler effektivt styrken af de kræfter, der virker på dem, og aktiveres, når den påførte kraft overstiger en given tærskelværdi. Von Willebrand Factor (VWF), som starter dannelsen af blodpropper, er en vigtig repræsentant for denne klasse.
De mekaniske kræfter, der kræves for at aktivere proteiner som VWF, er ofte så små, at deres størrelse ikke kunne bestemmes ved hjælp af eksisterende metoder. Nu, et team af forskere ledet af LMU -fysikere Dr. Martin Benoit og professor Jan Lipfert har udviklet en meget mere følsom procedure. Deres "magnetiske pincet" kan kvantificere kræfter, der er 100 gange mindre end den almindeligt anvendte alternative metode, der i øjeblikket er tilgængelig. Som Lipfert og kolleger rapporterer i tidsskriftet PNAS , de har brugt teknikken til at observere udfoldelsen af VWF -proteinet under påvirkning af lave mekaniske kræfter.
En kraftfuld tilgang til at studere mekanoregulering er såkaldt proteinkraftspektroskopi. Dette indebærer, at man trækker på et individuelt proteinmolekyle og observerer, hvordan en påført kraft ændrer sin tredimensionelle struktur. Indtil nu, den valgte metode til at trække har været et atomkraftmikroskop, som fungerer bedst i intervallet 100 piconewton (pN). "Imidlertid, mange molekylære processer aktiveres af kræfter, der er meget svagere end det, "siger Lipfert." Så til målinger på niveauet af enkelte molekyler, vi har brug for mere følsom instrumentering - det nytter ikke meget at bruge en badevægt til at afveje ingredienserne i en kage. "
Forskerne udviklede en metode, hvor proteinerne fastgøres i den ene ende til en glasoverflade og bærer et mærke i den anden ende, der binder til små magnetiske perler, og samlingen derefter udsættes for et eksternt magnetfelt. Forlængelse af proteinet induceret af feltet resulterer i den lodrette forskydning af hver perle, som kan detekteres ved mikroskopi. "Denne form for opsætning kaldes magnetisk pincet, "Lipfert forklarer." Det har den store fordel, at det giver os mulighed for at anvende og løse meget svage kræfter - betydeligt mindre end 1 piconewton - på proteinet af interesse. Ud over, Magnetisk pincet muliggør meget stabile målinger over lange perioder - op til en uge. "
For at teste den nye metode, LMU -gruppen brugte VWF som deres målprotein. I blodbanen, VWF cirkulerer som en multimer af dimerer, der er lavet af to identiske underenheder. Under normale betingelser for blodgennemstrømning, den har en relativt kompakt kugleform. Imidlertid, enhver forøgelse af forskydningskræfterne i blodbanen på grund af skade på vaskulaturen får vWF til at udfolde sig. Dette afslører bindingssteder for receptorer på blodplader. Binding af VWF til blodplader udløser igen en reaktionskaskade, der fører til koagulation, som forsegler såret. "Kaskaden induceres af virkningen på molekylet af mekaniske kræfter, der virker, som er meget svagere end dem, der er blevet målt indtil nu, "siger Lipfert. Analyse af udpakning af VWF-dimerer med magnetisk pincet viste, at den såkaldte VWF-stamme åbner sig under en påført kraft på mindre end 1 pN, når dimerenes underenheder trækkes fra hinanden som de to halvdele af en lynlås. "Vi antager, at dette adfærdsmønster, som vi var i stand til at observere for første gang, repræsenterer det første trin i blodkoagulation, "siger Lipfert." Vores tilgang giver et detaljeret billede af kræfterne og de ændringer i forlængelse, der er involveret i udfoldelse af proteinet. Vi er overbeviste om, at fremtidig anvendelse af metoden vil bidrage til en bedre forståelse af VWF's virkemåde og rollen som klinisk relevante mutationer.
Sidste artikelGebyrsvingninger:En ny ejendom i superledere
Næste artikelBrug af korrelerede fotoner til at forbedre røntgenbilleder
 Varme artikler
Varme artikler
-
 Hvordan man fremstiller en papirplade MarsMars har fascineret menneskeheden i århundreder. Det er blevet argumenteret for, om livet faktisk kunne opretholdes på Mars, hvilket gør det til en god planet at studere. Når du er færdig med din u
Hvordan man fremstiller en papirplade MarsMars har fascineret menneskeheden i århundreder. Det er blevet argumenteret for, om livet faktisk kunne opretholdes på Mars, hvilket gør det til en god planet at studere. Når du er færdig med din u -
 Beherskelse af metastabilt stofDetaljer om den eksperimentelle opsætning brugt af Hruby et al. for at studere metastabilitet og lavindynamik i et kvante mangekroppssystem. Kredit:ETH Zürich/D-PHYS Heidi Hostettler Fænomenet met
Beherskelse af metastabilt stofDetaljer om den eksperimentelle opsætning brugt af Hruby et al. for at studere metastabilitet og lavindynamik i et kvante mangekroppssystem. Kredit:ETH Zürich/D-PHYS Heidi Hostettler Fænomenet met -
 Forskere tager optisk enhed ud af laboratoriet og ind i klinikken for at opdage kræft i de tidligst…Fra venstre, Yao Shen, en kandidat i maskinteknik ved Worcester Polytechnic Institute (WPI), Yuxiang Shawn Liu, adjunkt i maskinteknik, og ph.d.-kandidat Chaoyang Ti med det apparat, de bruger til at
Forskere tager optisk enhed ud af laboratoriet og ind i klinikken for at opdage kræft i de tidligst…Fra venstre, Yao Shen, en kandidat i maskinteknik ved Worcester Polytechnic Institute (WPI), Yuxiang Shawn Liu, adjunkt i maskinteknik, og ph.d.-kandidat Chaoyang Ti med det apparat, de bruger til at -
 Optimalt design til akustisk ubemærkning i vandKredit:Pixabay/CC0 Public Domain Indtil nu, det var kun muligt at optimere en akustisk tilslagsstruktur til luftmiljøet. Imidlertid, med denne seneste forskning, Akustisk kappe designet med topolo
Optimalt design til akustisk ubemærkning i vandKredit:Pixabay/CC0 Public Domain Indtil nu, det var kun muligt at optimere en akustisk tilslagsstruktur til luftmiljøet. Imidlertid, med denne seneste forskning, Akustisk kappe designet med topolo
- Bølgede transistorer, der får lodret bredde uden at øge deres aftryk på chip til fremtidige flek…
- Forskere designer og patenterer grafenbiosensorer
- Anvendelsen af polynomier
- Enkeltmolekyler i en kvantefilm
- To gange brændt:Winklevii overskygget af Zuckerberg endnu engang
- Forskere bruger atomlagsaflejring til at dyrke bimetalliske nanopartikler


