Hvad er det periodiske mønster for atomradius?
I en periode :Når atomnummeret stiger over en periode, tilføjes flere protoner til kernen, hvilket øger kernens positive ladning og den tiltrækningskraft, der udøves på elektronerne. Dette får elektronerne til at blive trukket tættere på kernen, hvilket reducerer atomradius.
Ned en gruppe :Når man går ned i en gruppe, kommer der nye elektronskaller, som øger afstanden mellem de yderste elektroner og kernen. De ekstra elektronskaller fungerer som barrierer, der skærmer de yderste elektroner fra kernens positive ladning, hvilket reducerer tiltrækningskraften og øger atomradius.
Undtagelser:Der er nogle få undtagelser fra dette generelle mønster, hovedsageligt på grund af den uregelmæssige afskærmningseffekt af de indre elektronskaller. For eksempel er atomradierne for overgangsmetallerne i den fjerde periode (Y, Zr, Nb osv.) lidt større end forventet, mens atomradierne for gruppe 13 grundstoffer (B, Al, Ga osv.) er lidt mindre end forventet. Disse undtagelser kan tilskrives specifikke elektronkonfigurationer og interaktionerne mellem elektroner i atomerne.
Sammenfattende afspejler det periodiske mønster for atomradius samspillet mellem antallet af protoner og elektroner i et atom, såvel som den afskærmende effekt af indre elektronskaller, hvilket fører til de observerede tendenser på tværs af perioder og nedgrupper.
Sidste artikelHvilken er hurtigere?
Næste artikelhvad er volumen optaget af 15 g helium?
 Varme artikler
Varme artikler
-
 Ny egenskab af lys opdagetKredit:CC0 Public Domain Et team af forskere tilknyttet flere institutioner i Spanien og USA har annonceret, at de har opdaget en ny egenskab ved lys - selvmoment. I deres papir offentliggjort i t
Ny egenskab af lys opdagetKredit:CC0 Public Domain Et team af forskere tilknyttet flere institutioner i Spanien og USA har annonceret, at de har opdaget en ny egenskab ved lys - selvmoment. I deres papir offentliggjort i t -
 Forskere studerer virkningerne af cellulær trængsel på celletransportsystemetForskerne brugte højopløsningsmikroskopi og laseroptisk pincet til at studere motorproteiner. Kredit:George Shubeita Ligesom mange sygdomme, herunder neurodegenerative sygdomme som Alzheimers, er
Forskere studerer virkningerne af cellulær trængsel på celletransportsystemetForskerne brugte højopløsningsmikroskopi og laseroptisk pincet til at studere motorproteiner. Kredit:George Shubeita Ligesom mange sygdomme, herunder neurodegenerative sygdomme som Alzheimers, er -
 Kvantinterferens observeret i realtid:Ekstrem UV-lys spektroskopi teknikLaserpulser genererer og sporer elektronisk kvanteinterferens i et atom. Kredit:AG Stienkemeier Et team ledet af prof. Dr. Frank Stienkemeier og dr. Lukas Bruder fra Institut for Fysik ved Freibur
Kvantinterferens observeret i realtid:Ekstrem UV-lys spektroskopi teknikLaserpulser genererer og sporer elektronisk kvanteinterferens i et atom. Kredit:AG Stienkemeier Et team ledet af prof. Dr. Frank Stienkemeier og dr. Lukas Bruder fra Institut for Fysik ved Freibur -
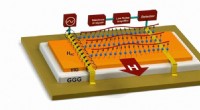 Magnonic enheder kan erstatte elektronik uden meget støjChip, der genererer en magnonisk strøm, eller spin bølge, mellem sende- og modtageantenner. Kredit:Balandin Lab ved UC Riverside Elektroniske enheder såsom transistorer bliver mindre og vil snart
Magnonic enheder kan erstatte elektronik uden meget støjChip, der genererer en magnonisk strøm, eller spin bølge, mellem sende- og modtageantenner. Kredit:Balandin Lab ved UC Riverside Elektroniske enheder såsom transistorer bliver mindre og vil snart
- Amerikanske militærs mystiske rumfly raketter tilbage mod kredsløb
- Værktøjer brugt af Early Explorers
- Hvad er den mest sandsynlige årsag til stor mangfoldighed, der i øjeblikket ses i flercellet livsf…
- Ormer i økosystemet
- Cybersikkerhedsstartups spreder sig, men det er svært at finde ud af, hvad der virker og ikke gør
- Gingko Biloba blade hjælper med at spore klimaændringer


