Hvordan påvirker elektrostatiske kræfter elektronerne i et atom?
1. Traktion til kernen :Den positivt ladede kerne i et atom udøver en elektrostatisk tiltrækning på de negativt ladede elektroner. Denne tiltrækkende kraft binder elektronerne til kernen og holder dem i kredsløb omkring den.
2. Elektronkonfiguration :De elektrostatiske vekselvirkninger mellem elektroner og den positivt ladede kerne bestemmer elektronkonfigurationen af et atom. Elektroner arrangerer sig i skaller og underskaller omkring kernen baseret på deres energiniveauer og de elektrostatiske kræfter, de oplever.
3. Kvantetilstande :Elektrostatiske kræfter påvirker de kvantetilstande, som elektroner optager i et atom. Energiniveauerne for elektronorbitaler bestemmes af balancen mellem den tiltrækkende kraft fra kernen og de frastødende kræfter mellem elektroner.
4. Elektrondensitet og afskærmning :Den elektrostatiske frastødning mellem elektroner af samme spin fører til elektrondensitetsfordeling inden for et atom. De indre elektroner beskytter de ydre elektroner fra kernens fulde tiltrækkende kraft, hvilket påvirker deres energiniveauer og kemiske egenskaber.
5. Kemisk binding :Elektrostatiske kræfter er fundamentale i kemisk binding. Tiltrækningen mellem positivt ladede atomkerner og negativt ladede elektroner driver dannelsen af ionbindinger. Kovalente bindinger involverer deling af elektroner mellem atomer for at opnå en mere stabil elektrostatisk konfiguration.
6. Polaritet og dipolmomenter :Elektrostatiske kræfter skaber polaritet i molekyler. Når elektroner er ujævnt fordelt på grund af forskelle i elektronegativitet, får et molekyle et dipolmoment. Denne polaritet påvirker intermolekylære interaktioner og forskellige molekylære egenskaber.
7. Metallisk binding :I metaller holder den elektrostatiske tiltrækning mellem positivt ladede metalioner og det omgivende hav af mobile elektroner metalgitteret sammen. Denne metalliske binding giver anledning til metallers karakteristiske egenskaber, såsom høj elektrisk og termisk ledningsevne.
Overordnet set styrer elektrostatiske kræfter interaktionerne mellem elektroner og kernen, hvilket dikterer elektronkonfigurationen, kemisk binding og mange grundlæggende egenskaber ved atomer og molekyler. Forståelse af disse elektrostatiske interaktioner er afgørende for at forstå stoffets adfærd på atom- og molekylskalaen.
 Varme artikler
Varme artikler
-
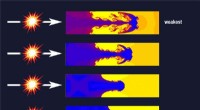 Hurtig komprimering førte til tryk af planetarisk kerne, der viste sig at gøre det stærkere end s…Påføringen af stress på et fast stof får materialet til at flyde - et fænomen kendt som Rayleigh-Taylor ustabilitet. Dette flow får krusninger mønstret på materialets overflade til at vokse, danner
Hurtig komprimering førte til tryk af planetarisk kerne, der viste sig at gøre det stærkere end s…Påføringen af stress på et fast stof får materialet til at flyde - et fænomen kendt som Rayleigh-Taylor ustabilitet. Dette flow får krusninger mønstret på materialets overflade til at vokse, danner -
 Ny fase af modellering af de viskøse koblingseffekter af flerfaset væskestrømForudsigelse af flerfasepermeabiliteten i porehals ved at bruge kunstigt neuralt netværk. Kredit:I2CNER, Kyushu Universitet Mange applikationer, herunder kuldioxidlagring og olieudvinding, involve
Ny fase af modellering af de viskøse koblingseffekter af flerfaset væskestrømForudsigelse af flerfasepermeabiliteten i porehals ved at bruge kunstigt neuralt netværk. Kredit:I2CNER, Kyushu Universitet Mange applikationer, herunder kuldioxidlagring og olieudvinding, involve -
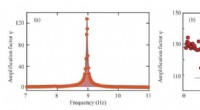 Gennemgang af ædelgasspinforstærkning via spin-udvekslingskollisionerFrekvensresponsen af 87Rb magnetometeret på oscillerende felter langs y, assisteret med 129Xe spin-baseret forstærker. De eksperimentelle data (røde cirkler) opnås ved at scanne hjælpefeltfrekvenser
Gennemgang af ædelgasspinforstærkning via spin-udvekslingskollisionerFrekvensresponsen af 87Rb magnetometeret på oscillerende felter langs y, assisteret med 129Xe spin-baseret forstærker. De eksperimentelle data (røde cirkler) opnås ved at scanne hjælpefeltfrekvenser -
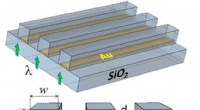 Forskere foreslog en ny konfiguration af nanoskoperSkemaer af et maskeret fasediffraktionsgitter. Kredit:Tomsk Polytechnic University Forskere fra Tomsk Polytechnic University foreslog sammen med kolleger at bruge specielle diffraktionsgitre med g
Forskere foreslog en ny konfiguration af nanoskoperSkemaer af et maskeret fasediffraktionsgitter. Kredit:Tomsk Polytechnic University Forskere fra Tomsk Polytechnic University foreslog sammen med kolleger at bruge specielle diffraktionsgitre med g
- Hvorfor er quinin fluorescerende?
- Hvorfor skal du tænde din telefon i lufthavnens sikkerhed?
- Hvad er destillation af vand og blæk nyttig til?
- Sådan fungerer kloning
- Når verdener kolliderer:Studerer nedslagskratere for at afdække solsystemets hemmeligheder
- Lavpris, ultrahurtig DNA-sekventering bringer diagnostisk brug tættere på


