Hvor mange elektroner findes i hvert underniveau?
s underniveau:
s-underniveauet har en enkelt orbital og kan indeholde op til 2 elektroner.
p Underniveau:
p-underniveauet har tre orbitaler (px, py, pz) og kan indeholde op til 6 elektroner.
d Underniveau:
d-underniveauet har fem orbitaler (dxz, dyz, dxy, dx2-y2, dz2) og kan indeholde op til 10 elektroner.
f Underniveau:
f-underniveauet har syv orbitaler (fx, fy, fz, fxy, fxz, fyz, f(x2-y2)) og kan rumme op til 14 elektroner.
Det er vigtigt at bemærke, at disse tal repræsenterer den maksimale belægning for hvert underniveau. Hvis der er tale om atomer med mere end én elektron i et underniveau, vil elektronerne optage orbitalerne efter Aufbau-princippet, som siger, at elektroner optager de laveste energiorbitaler, der er tilgængelige, før de bevæger sig til højere energiniveauer.
Sidste artikelHvad er de tre orbitaler i et P-underniveau?
Næste artikelHvad er 310 grader Fahrenheit i Celsius?
 Varme artikler
Varme artikler
-
 3D-atomur med kvantgas tilbyder nye målingerJILAs tredimensionelle (3-D) kvantegas atomur består af et lysgitter dannet af tre par laserstråler. Flere lasere i forskellige farver bruges til at afkøle atomerne, fange dem i et gitter af lys, og u
3D-atomur med kvantgas tilbyder nye målingerJILAs tredimensionelle (3-D) kvantegas atomur består af et lysgitter dannet af tre par laserstråler. Flere lasere i forskellige farver bruges til at afkøle atomerne, fange dem i et gitter af lys, og u -
 Lysfølende kamera kan hjælpe med at registrere udenjordisk liv, mørkt stofMikrograf af NISTs højopløsningskamera lavet af 1, 024 sensorer, der tæller enkelte fotoner, eller lyspartikler. Kameraet er designet til fremtidige rumbaserede teleskoper, der leder efter kemiske teg
Lysfølende kamera kan hjælpe med at registrere udenjordisk liv, mørkt stofMikrograf af NISTs højopløsningskamera lavet af 1, 024 sensorer, der tæller enkelte fotoner, eller lyspartikler. Kameraet er designet til fremtidige rumbaserede teleskoper, der leder efter kemiske teg -
 Beregning af Hawking-stråling ved begivenhedshorisonten for et sort hulKredit:RUDN Universitet En RUDN University fysiker har udviklet en formel til beregning af Hawking-stråling på begivenhedshorisonten af et sort hul, som gør det muligt for fysikere at bestemme,
Beregning af Hawking-stråling ved begivenhedshorisonten for et sort hulKredit:RUDN Universitet En RUDN University fysiker har udviklet en formel til beregning af Hawking-stråling på begivenhedshorisonten af et sort hul, som gør det muligt for fysikere at bestemme, -
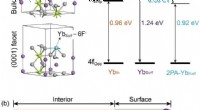 Molekyle-medieret overfladerekonstruktion muliggør en kæmpe opkonvertering af luminescensFigur:(a) Skematisk illustration af koordinations- og 4f-energiniveauer af trivalente ytterbiumioner, der befinder sig i det indre (Ybin, top) og overflade (Ybsurf, nederst) af en NaYF 4 nanopartike
Molekyle-medieret overfladerekonstruktion muliggør en kæmpe opkonvertering af luminescensFigur:(a) Skematisk illustration af koordinations- og 4f-energiniveauer af trivalente ytterbiumioner, der befinder sig i det indre (Ybin, top) og overflade (Ybsurf, nederst) af en NaYF 4 nanopartike
- Hvor varmt skal vandet smelte plast?
- Tesla afslører planer om at bygge biler i Shanghai
- Det bedste af to verdener:Magnetisme og Weyl -halvmetaller
- Activision går ned efter split med Bungie
- Påvisning af hydrotermiske ventilationsåbninger i vulkanske søer
- Overlegen bio-blæk til 3-D-print blev banebrydende


