Hvad er mængden af varme, der kræves for at ændre et objekts temperatur nøjagtigt 1 grad Celsius?
Formlen til at beregne mængden af varme, der kræves for at ændre et objekts temperatur er:
Q =mcAT
Hvor:
* Q er mængden af varme i joule (J)
* m er objektets masse i kilogram (kg)
* c er objektets specifikke varmekapacitet i joule pr. kilogram-kelvin (J/kg-K)
* ΔT er ændringen i temperatur i kelvin (K)
For eksempel, hvis du vil hæve temperaturen på 1 kg vand med 1 grad Celsius, skal du tilføje 4184 joule varme. Dette skyldes, at vands specifikke varmekapacitet er 4184 J/kg-K.
Forskellige materialer har forskellige specifikke varmekapaciteter. Her er nogle almindelige materialer og deres specifikke varmekapacitet:
* Vand:4184 J/kg-K
* Aluminium:897 J/kg-K
* Kobber:385 J/kg-K
* Jern:449 J/kg-K
* Træ:1700 J/kg-K
Som du kan se, har vand en relativt høj specifik varmekapacitet, hvilket betyder, at der skal meget varme til for at hæve dets temperatur. Dette er grunden til, at vand ofte bruges som kølemiddel i motorer og andre enheder, der genererer varme.
 Varme artikler
Varme artikler
-
 Forskere dokumenterer transformation af grafit til sekskantet diamantDCS-totrins-gaspistolen, der bruges til eksperimenter, er forbundet med APS-røntgenstrålen. Kredit:Washington State University En ny undersøgelse fra Washington State University forskere besvarer
Forskere dokumenterer transformation af grafit til sekskantet diamantDCS-totrins-gaspistolen, der bruges til eksperimenter, er forbundet med APS-røntgenstrålen. Kredit:Washington State University En ny undersøgelse fra Washington State University forskere besvarer -
 Verdens mindste, bedste akustiske forstærker fremgår af 50 år gammel hypoteseEn akustisk-elektrisk chip, top, produceret på Sandia National Laboratories inkluderer en radiofrekvensforstærker, cirkulator og filter. Et billede taget ved scanning elektronmikroskopi viser detaljer
Verdens mindste, bedste akustiske forstærker fremgår af 50 år gammel hypoteseEn akustisk-elektrisk chip, top, produceret på Sandia National Laboratories inkluderer en radiofrekvensforstærker, cirkulator og filter. Et billede taget ved scanning elektronmikroskopi viser detaljer -
 Nyt bevis afslører grundlæggende grænser for videnskabelig videnEn korrekt forudsigelse (venstre), og en forkert forudsigelse (højre). Illustration af Joerael Elliott, baseret på et diagram af David Wolpert. Kredit:Santa Fe Institute Et nyt bevis fra SFI-profe
Nyt bevis afslører grundlæggende grænser for videnskabelig videnEn korrekt forudsigelse (venstre), og en forkert forudsigelse (højre). Illustration af Joerael Elliott, baseret på et diagram af David Wolpert. Kredit:Santa Fe Institute Et nyt bevis fra SFI-profe -
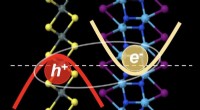 Excitoner danner superfluid i visse 2-D-kombinationerRice University -teoretikere fastslog, at visse kombinationer af svagt bundne 2D -materialer lader huller og elektroner kombinere til excitoner ved materialernes grundtilstand. Denne kombination kan f
Excitoner danner superfluid i visse 2-D-kombinationerRice University -teoretikere fastslog, at visse kombinationer af svagt bundne 2D -materialer lader huller og elektroner kombinere til excitoner ved materialernes grundtilstand. Denne kombination kan f
- BMI-systemet lader brugere styre robotarmen, mens deres hænder er optaget af at gøre noget andet
- Kan fremmede civilisationer opdage menneskeheden?
- Uddybende spørgsmål:Hvorfor er nogle døve i stand til at spille instrumenter?
- Ledningsklippere får mere selskab:Antallet af betalings-tv-abonnenter falder
- Hvorfor absorberer epiblema og rodhår ioner ved at bruge energi?
- Et globalt nord-til-syd-skift i vindkraft ved slutningen af århundredet


