I en af de klassiske nukleare fysiske eksperimenter i begyndelsen af det 20. århundrede blev en alfa -partikel accelereret mod en guldkerne og dens sti, der væsentligt blev afbøjet af Coulomb?
Her er en sammenbrud af, hvad der skete:
* Opsætningen: Alpha -partikler (positivt ladede heliumkerner) blev fyret ved en tynd guldfolie.
* Forventningen: Baseret på den fremherskende "blommepudding -model" af atomet (hvor positiv ladning blev antaget at være fordelt over hele atomet) forventedes alfa -partiklerne at passere gennem folien med kun små afbøjninger.
* overraskelsen: Til alles forbløffelse blev en lille, men betydelig brøkdel af alfa -partiklerne afbøjet i meget store vinkler, nogle hoppede endda tilbage direkte mod kilden!
* Fortolkningen: Rutherford indså, at dette spredningsmønster kun kunne forklares, hvis den positive ladning af atomet var koncentreret i en lille, tæt kerne kaldet kernen. Alfa -partiklerne, der blev positivt ladet, blev afviset af denne positivt ladede kerne, hvilket forårsager de store afbøjninger.
Key takeaways fra Rutherford Spredningseksperimentet:
* Atomet er for det meste tomt rum.
* Den positivt ladede kerne er en lille, tæt region i midten af atomet.
* Elektronerne kredser om kernen i en relativt stor afstand.
Dette eksperiment revolutionerede vores forståelse af atomstruktur og banede vejen for yderligere udvikling inden for nuklear fysik.
Sidste artikelHvilke kræfter handler altid i lige men modsatte par?
Næste artikelHvilken temperatur demagnetiserer en magnet?
 Varme artikler
Varme artikler
-
 Partnerskab giver bedre instrumentering og muliggør bedre viden om komplekse væskerRheometer udviklet af UCSBs Helgeson Lab og instrumenteringsproducent Anton Paar Kredit:Scott Condon Har du nogensinde spekuleret på, hvorfor du skal ryste din flaske ketchup eller sennep, før du
Partnerskab giver bedre instrumentering og muliggør bedre viden om komplekse væskerRheometer udviklet af UCSBs Helgeson Lab og instrumenteringsproducent Anton Paar Kredit:Scott Condon Har du nogensinde spekuleret på, hvorfor du skal ryste din flaske ketchup eller sennep, før du -
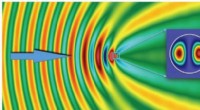 Kæmpe forbedring af elektromagnetiske bølger afsløret i små dielektriske partiklerMagnetfeltets intensitet ved spredning af en elektromagnetisk bølge. Hændelsesbølgen formerer sig fra venstre mod højre, som den er angivet med den blå pil. Farvebjælken har forskellige skalaer for fe
Kæmpe forbedring af elektromagnetiske bølger afsløret i små dielektriske partiklerMagnetfeltets intensitet ved spredning af en elektromagnetisk bølge. Hændelsesbølgen formerer sig fra venstre mod højre, som den er angivet med den blå pil. Farvebjælken har forskellige skalaer for fe -
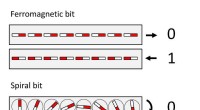 Nyt datalagringsmateriale bevarer sine specielle magnetiske egenskaber selv ved stuetemperaturLagring af oplysninger med spiraler. I de fleste computerhukommelser er 0/1 værdierne knyttet til højre/venstre retning af små magneter. I en potentiel magnetoelektrisk hukommelse, de samme små magnet
Nyt datalagringsmateriale bevarer sine specielle magnetiske egenskaber selv ved stuetemperaturLagring af oplysninger med spiraler. I de fleste computerhukommelser er 0/1 værdierne knyttet til højre/venstre retning af små magneter. I en potentiel magnetoelektrisk hukommelse, de samme små magnet -
 Quantum dots tilbyder ny platform til fingerspidser terahertz -enhederKredit:ITMO University Forskere fra Rusland og Storbritannien har udviklet en antenne, der kan hjælpe med at reducere kilder til terahertz -stråling ned til størrelsen af en fingerspids. Antenne
Quantum dots tilbyder ny platform til fingerspidser terahertz -enhederKredit:ITMO University Forskere fra Rusland og Storbritannien har udviklet en antenne, der kan hjælpe med at reducere kilder til terahertz -stråling ned til størrelsen af en fingerspids. Antenne
- Forskere finder, at algeforfader er nøglen til, hvordan dødelige patogener formerer sig
- Den perfekte julegave? En snemand i nanoskala
- Hvorfor skal raketten gå sidelæns?
- Skovduff skal overvejes ved kontrolleret afbrænding for at undgå at beskadige træer
- Højintensiv rumlig-mode styrbar frekvens op-konverter mod on-chip integration
- Mekaniske ulemper ved et løftesystem


