Hvad er drivkraften, der får sagen til at ændre fase?
* Tilføjelse af energi: Når energi tilsættes til et stof, får molekylerne inden i det kinetisk energi. Dette får dem til at vibrere hurtigere og bevæge sig længere fra hinanden.
* fast til væske (smeltning): Tilføjelse af nok energi bryder de stive bindinger, der holder molekylerne i en fast gitterstruktur, så de kan strømme mere frit.
* væske til gas (kogning/fordampning): Tilføjelse af endnu mere energi overvinder de intermolekylære kræfter helt, hvilket får molekylerne til at sprede sig og bevæge sig uafhængigt som en gas.
* Fjernelse af energi: Når energi fjernes fra et stof, mister molekylerne kinetisk energi, hvilket får dem til at vibrere langsommere og bevæge sig tættere sammen.
* gas til væske (kondens): Fjernelse af energi bremser gasmolekyler, så de kan danne svage bindinger og blive en væske.
* væske til fast (frysning): Fjernelse af endnu mere energi får molekylerne til at bremse markant og låse sig ind i en fast gitterstruktur og danne et fast stof.
Nøglepunkter:
* Temperatur: Temperaturen er et mål for den gennemsnitlige kinetiske energi af molekyler. Højere temperaturer betyder mere energi og en større sandsynlighed for faseændringer.
* tryk: Tryk kan også påvirke faseændringer. Stigende tryk kan tvinge molekyler tættere sammen, fremme kondens eller frysning.
* entalpi af faseændring: Mængden af energi, der kræves for at forårsage en faseændring (f.eks. Meltning, kogning) kaldes henholdsvis entalpien af fusion eller entalpi af fordampning. Denne energi bruges til at bryde bindingerne, der holder molekylerne i den oprindelige tilstand.
Afslutningsvis er drivkraften bag faseændringer ændringen i energi, der påvirker bevægelsen og arrangementet af molekyler i et stof. Denne energi kan overføres gennem varme, tryk eller andre mekanismer.
 Varme artikler
Varme artikler
-
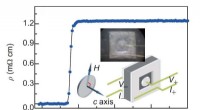 Superledning med todelt symmetri-nyt bevis for topologisk superleder SrxBi2Se3Temperaturafhængighed af resistivitet for S1 ved nulfelt. Indsætningerne viser fotografiet af S1 med elektroderne (ovenfor) og den Corbino-formede elektrodekonfiguration (nedenfor). Kredit:©Science Ch
Superledning med todelt symmetri-nyt bevis for topologisk superleder SrxBi2Se3Temperaturafhængighed af resistivitet for S1 ved nulfelt. Indsætningerne viser fotografiet af S1 med elektroderne (ovenfor) og den Corbino-formede elektrodekonfiguration (nedenfor). Kredit:©Science Ch -
 Trinvis inversionsmetode til profilering af nær-borehulsformationshastighederKredit:CC0 Public Domain Den radiale heterogenitet af dannelsen af nær-brøndboringer, normalt manifesteret som variationer af formationsbølgehastigheder i radial position, er stødt på i olieefte
Trinvis inversionsmetode til profilering af nær-borehulsformationshastighederKredit:CC0 Public Domain Den radiale heterogenitet af dannelsen af nær-brøndboringer, normalt manifesteret som variationer af formationsbølgehastigheder i radial position, er stødt på i olieefte -
 Sådan får du øje på et ormehul (hvis de findes)En kunstners koncept illustrerer et supermassivt sort hul. En ny teoretisk undersøgelse skitserer en metode, der kunne bruges til at søge efter ormehuller (et spekulativt fænomen) i baggrunden af su
Sådan får du øje på et ormehul (hvis de findes)En kunstners koncept illustrerer et supermassivt sort hul. En ny teoretisk undersøgelse skitserer en metode, der kunne bruges til at søge efter ormehuller (et spekulativt fænomen) i baggrunden af su -
 Gennembrud i styring af lystransmissionSkematisk af den realiserede isolator, dannet af to koblede ikke -lineære resonatorer forbundet via en forsinkelseslinje. Kredit:Andrea Alu Driften af moderne teknologi kræver en stadig stigende
Gennembrud i styring af lystransmissionSkematisk af den realiserede isolator, dannet af to koblede ikke -lineære resonatorer forbundet via en forsinkelseslinje. Kredit:Andrea Alu Driften af moderne teknologi kræver en stadig stigende
- Ikke-detektering af nøglesignal gør det muligt for astronomer at bestemme, hvad de første galakse…
- NASA udforsker vores ferskvandsverden i forandring
- Hvilke elementer findes Clorox servietter?
- Fugle vs. bier:Undersøgelse hjælper med at forklare, hvordan blomster udviklede sig for at få bes…
- Biologisk risikopotentiale for nanopartikler undersøgt
- Verdens bredeste grafen nanobånd lover den næste generation af miniaturiseret elektronik


