Hvilken type kraft findes mellem molekyler?
Her er de vigtigste typer intermolekylære kræfter:
1. Van der Waals Forces:
* London Dispersion Forces (LDF): Dette er den svageste type intermolekylær kraft og forekommer på grund af midlertidige, inducerede dipoler i ikke -polære molekyler. Selvom molekylet er generelt neutral, bevæger elektronerne konstant, hvilket fører til midlertidige ujævne ladningsfordelinger. Disse midlertidige dipoler kan inducere dipoler i nærliggende molekyler, hvilket fører til en svag attraktion. LDF'er findes mellem alle molekyler, men de er den eneste intermolekylære kraft, der er til stede i ikke -polære molekyler.
* dipol-dipol-kræfter: Disse kræfter forekommer mellem polære molekyler (molekyler med permanente dipoler på grund af ujævn deling af elektroner). Den positive ende af et molekyle tiltrækkes af den negative ende af et andet molekyle. Dipol-dipolkræfter er stærkere end LDF'er.
* Hydrogenbinding: En speciel type dipol-dipolinteraktion, der opstår, når brint er bundet til et stærkt elektronegativt atom som ilt, nitrogen eller fluor. Dette skaber en meget stærk dipol, hvilket resulterer i en stærk attraktion mellem molekyler. Hydrogenbinding er ansvarlig for mange af de unikke egenskaber ved vand, såsom dets høje kogepunkt.
2. Ion-dipolstyrker: Disse forekommer mellem ioner og polære molekyler. Ionen tiltrækkes af den modsatte ladede ende af dipolen. Disse kræfter er stærkere end dipol-dipolkræfter.
Styrken af intermolekylære kræfter afhænger af flere faktorer, herunder:
* Polaritet: Polære molekyler har stærkere intermolekylære kræfter end ikke -polære molekyler.
* molekylær størrelse og form: Større molekyler og molekyler med mere komplekse former har stærkere LDF'er.
* Hydrogenbinding: Tilstedeværelsen af hydrogenbinding fører til signifikant stærkere intermolekylære kræfter.
Betydningen af intermolekylære kræfter:
Intermolekylære kræfter er ansvarlige for mange vigtige fysiske egenskaber ved stof, herunder:
* smeltepunkt og kogepunkt: Stærkere intermolekylære kræfter resulterer i højere smelte- og kogepunkter.
* Viskositet: Væsker med stærkere intermolekylære kræfter er mere tyktflydende (flow langsommere).
* overfladespænding: Væsker med stærkere intermolekylære kræfter har højere overfladespænding.
* opløselighed: Lignende intermolekylære kræfter mellem opløst stof og opløsningsmiddelmolekyler fører til bedre opløselighed.
At forstå intermolekylære kræfter er vigtig for at forklare stoffet i forskellige tilstande og for at forudsige egenskaberne for forskellige stoffer.
Sidste artikelHvad sker der, når flyet går hurtigere end hastighedslyd?
Næste artikelHvad er SI -enheden af amplitude en bølge?
 Varme artikler
Varme artikler
-
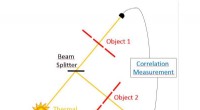 Brug af termiske lyskilder til at tage nøjagtige afstandsmålingerForenklet skema over sanseteknikken offentliggjort i Optics Express. Kredit:University of Portsmouth Ny forskning har gjort det muligt for første gang at sammenligne de rumlige strukturer og posit
Brug af termiske lyskilder til at tage nøjagtige afstandsmålingerForenklet skema over sanseteknikken offentliggjort i Optics Express. Kredit:University of Portsmouth Ny forskning har gjort det muligt for første gang at sammenligne de rumlige strukturer og posit -
 Konform meta -overfladebelægning eliminerer krydstale og krymper bølgeledereStavformet bølgeleder med to kvasi-todimensionale konforme belægninger, der afskærer bølgelederen fra krydstale og blokerer og tillader bølgelederen at være mindre. Kredit:Werner Lab / Penn State
Konform meta -overfladebelægning eliminerer krydstale og krymper bølgeledereStavformet bølgeleder med to kvasi-todimensionale konforme belægninger, der afskærer bølgelederen fra krydstale og blokerer og tillader bølgelederen at være mindre. Kredit:Werner Lab / Penn State -
 Forskere fandt og studerede komplekse typer defekter i dråberne af flydende krystallerDråber af en kolesterisk flydende krystal set gennem et polariserende mikroskop. Kredit:Mikhail Krakhalev. Et team af forskere fra Kirensky Institute of Physics fra Siberian Branch of Russian Acad
Forskere fandt og studerede komplekse typer defekter i dråberne af flydende krystallerDråber af en kolesterisk flydende krystal set gennem et polariserende mikroskop. Kredit:Mikhail Krakhalev. Et team af forskere fra Kirensky Institute of Physics fra Siberian Branch of Russian Acad -
 Forskere modellerer fotoluminescenskinetik i halvleder nanoplader for bedre optoelektronikKredit:CC0 Public Domain Forskere fra Skoltech og deres kolleger har bygget to modeller, der præcist forklarer den lysemitterende adfærd af halvleder nanoplader, små strukturer, der kan blive bygg
Forskere modellerer fotoluminescenskinetik i halvleder nanoplader for bedre optoelektronikKredit:CC0 Public Domain Forskere fra Skoltech og deres kolleger har bygget to modeller, der præcist forklarer den lysemitterende adfærd af halvleder nanoplader, små strukturer, der kan blive bygg
- Hvilken planet tager 248,5 jordår at gå rundt om solen?
- Hvordan ændrer oversvømmelser landskabsformer?
- Lavastrøm set på den urolige Alaska-vulkan
- Hvad er sammensat ord, der begynder med klima?
- Forskning i perovskit-silicium tandemceller viser ny vej at gå
- Hvilke typer stjerne har lav temperatur og høj lysstyrke?


