Hvorfor er tiltrækningskræfterne i ædle gasser svage?
* Fuld valensskaller: Noble gasser har en komplet ydre skal af elektroner (også kaldet valenselektroner). Dette betyder, at de har en stabil oktetkonfiguration (undtagen helium, der har en duet).
* Mangel på polaritet: Fordi de har en komplet ydre skal, danner ædle gasser ikke let bindinger med andre atomer. De er ikke polariserbare, hvilket betyder, at deres elektronskyer ikke let forvrænges, og der er ingen signifikant adskillelse af ladning inden for atomet.
* van der Waals Forces: De eneste kræfter, der handler mellem ædle gasatomer, er svage van der Waals -styrker, specifikt London -spredningskræfter. Disse kræfter stammer fra midlertidige udsving i elektronfordeling, hvilket skaber flygtige, øjeblikkelige dipoler, der svagt tiltrækker nærliggende atomer.
* lave kogepunkter: Som et resultat af disse svage kræfter har ædle gasser meget lave kogepunkter. De findes som gasser ved stuetemperatur og kondenseres kun til væsker ved ekstremt lave temperaturer.
Kortfattet: Noble gasser er ureaktive og har svage interatomiske kræfter, fordi de har en stabil elektronkonfiguration, hvilket gør dem meget stabile og tilbageholdende med at dele eller overføre elektroner.
 Varme artikler
Varme artikler
-
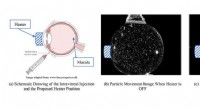 Opvarmningsteknikker kan forbedre behandlingen af makuladegenerationEn sammenligning af eksperimentelle resultater mellem varmelegeme slukket og varmelegeme tændt. Kredit:Gharib Research Group Aldersrelateret makuladegeneration er den primære årsag til centralt sy
Opvarmningsteknikker kan forbedre behandlingen af makuladegenerationEn sammenligning af eksperimentelle resultater mellem varmelegeme slukket og varmelegeme tændt. Kredit:Gharib Research Group Aldersrelateret makuladegeneration er den primære årsag til centralt sy -
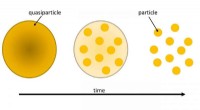 At dræbe en kvasipartikel:En kvante whodunitOver tid, mange-legeme dephasing dræber kvasipartiklernes lighed med en enkelt partikel. Kredit:FLEET I store systemer af interagerende partikler i kvantemekanik, et spændende fænomen dukker ofte
At dræbe en kvasipartikel:En kvante whodunitOver tid, mange-legeme dephasing dræber kvasipartiklernes lighed med en enkelt partikel. Kredit:FLEET I store systemer af interagerende partikler i kvantemekanik, et spændende fænomen dukker ofte -
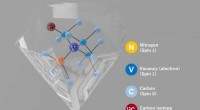 Fejltolerant kvantecomputerhukommelse i diamantNitrogen-vacancy (NV) center i diamant tjener som kvantehukommelse, som er fejlkorrektionskodet til automatisk at korrigere fejl. Kredit:Yokohama National University Quantum computing rummer potent
Fejltolerant kvantecomputerhukommelse i diamantNitrogen-vacancy (NV) center i diamant tjener som kvantehukommelse, som er fejlkorrektionskodet til automatisk at korrigere fejl. Kredit:Yokohama National University Quantum computing rummer potent -
 Renoveringer fører til store forbedringer på Nuclear Astrophysics labI dette billede, mere end 2 kilowatt protonstråle, der rammer den vandkølede, wolframforstærket strålestop for enden af ECRIS-accelerationssøjlen, set gennem dens visningsportal. Kredit:Arthur E. Ch
Renoveringer fører til store forbedringer på Nuclear Astrophysics labI dette billede, mere end 2 kilowatt protonstråle, der rammer den vandkølede, wolframforstærket strålestop for enden af ECRIS-accelerationssøjlen, set gennem dens visningsportal. Kredit:Arthur E. Ch
- Hvordan skelner du rockstrata ved geologisk sammensætning?
- Hvordan Pet Psychics fungerer
- Sådan genkendes Rough Agate
- Hvordan kan overflademorfologi ændre selektiviteten i elektrokatalyse?
- Hvad er eksempler på mekanisk forvitring?
- Pilotskalaanlæg til udvinding af sjældne jordartselementer i hjertet af kullandet


