Når stof ændrer sig fra en fase til en anden, hvad sker der molekylernes bevægelse, og hvordan påvirker det afstandsmolekyler?
1. Solid til væske (smeltning):
* molekylær bevægelse: Molekyler i et fast stof er tæt pakket og vibrerer i faste positioner. Efterhånden som energi (varme) tilføjes, bliver disse vibrationer mere energiske. Til sidst overvinder vibrationerne de attraktive kræfter, der holder molekylerne i en stiv struktur, hvilket giver dem mulighed for at bevæge sig mere frit.
* afstand: Molekylerne bevæger sig længere fra hinanden, når den stive struktur bryder sammen, hvilket fører til en mindre tæt tilstand.
2. Væske til gas (kogning eller fordampning):
* molekylær bevægelse: I en væske kan molekyler bevæge sig mere frit, men de er stadig relativt tæt sammen. Efterhånden som der tilføjes mere energi, bevæger molekylerne sig hurtigere og har nok energi til at overvinde de attraktive kræfter, der holder dem sammen. De slipper ud i den gasformige fase.
* afstand: Molekylerne bliver vidt adskilt fra hinanden, når de kommer ind i den gasformige fase.
3. Gas til væske (kondens):
* molekylær bevægelse: Gasmolekyler bevæger sig meget hurtigt og er langt fra hinanden. Når de mister energi (afkøling), bremser de ned, og de attraktive kræfter mellem dem bliver mere betydningsfulde. Dette giver dem mulighed for at klumpe sammen som en væske.
* afstand: Molekylerne bliver tættere pakket.
4. Væske til fast (frysning):
* molekylær bevægelse: Når væsken afkøles, bremser molekylerne, og deres vibrationer falder. På frysepunktet arrangerer molekylerne sig i et regelmæssigt, ordnet mønster (krystalgitter).
* afstand: Molekylerne bliver tæt pakket sammen og danner en solid struktur.
Nøglepunkter:
* Energi: Faseændringer er drevet af ændringer i energi (varme) af molekylerne.
* attraktive kræfter: Styrken af de attraktive kræfter mellem molekyler bestemmer fasen ved en given temperatur og tryk.
* densitet: Tætheden af et stof ændrer sig, når det overgår mellem faser på grund af ændringerne i afstanden mellem molekyler.
Fortæl mig, hvis du gerne vil have flere detaljer om en bestemt faseændring!
 Varme artikler
Varme artikler
-
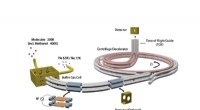 Kolde molekyler på kollisionskursSkematisk visning af den eksperimentelle opsætning af cryofugen. Kredit:MPQ, Quantum Dynamics Division Hvordan forløber kemiske reaktioner ved ekstremt lave temperaturer? Svaret kræver undersøgels
Kolde molekyler på kollisionskursSkematisk visning af den eksperimentelle opsætning af cryofugen. Kredit:MPQ, Quantum Dynamics Division Hvordan forløber kemiske reaktioner ved ekstremt lave temperaturer? Svaret kræver undersøgels -
 Højteknologiske kontaktlinser korrigerer farveblindhedDisse billeder illustrerer den effekt, en metasurface-baseret kontaktlinse ville have på en person med deuteranomali. Det venstre billede viser det originale scenario, mens det midterste billede er, h
Højteknologiske kontaktlinser korrigerer farveblindhedDisse billeder illustrerer den effekt, en metasurface-baseret kontaktlinse ville have på en person med deuteranomali. Det venstre billede viser det originale scenario, mens det midterste billede er, h -
 Hvad betyder lysstyrke i partikelfysik?Kredit:Sandbox Studio, Chicago/Ariel Davis Selv på de varmeste og tørreste dage, stråler fra solen er for svage til at antænde en ild. Men med et forstørrelsesglas (eller, i nogle uheldige tilfæld
Hvad betyder lysstyrke i partikelfysik?Kredit:Sandbox Studio, Chicago/Ariel Davis Selv på de varmeste og tørreste dage, stråler fra solen er for svage til at antænde en ild. Men med et forstørrelsesglas (eller, i nogle uheldige tilfæld -
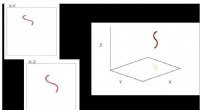 Forskere afslører 3D-bevægelse af nematoden C. elegansJerzy Blawzdziewicz, professor, medformand og direktør for kandidatstudier på Institut for Maskinteknik, og Siva Vanapalli, en lektor og Bill Sanderson fakultet stipendiat i Department of Chemical Eng
Forskere afslører 3D-bevægelse af nematoden C. elegansJerzy Blawzdziewicz, professor, medformand og direktør for kandidatstudier på Institut for Maskinteknik, og Siva Vanapalli, en lektor og Bill Sanderson fakultet stipendiat i Department of Chemical Eng
- Hvad er ammoniak lavet af, og hvilke anvendelser er det?
- Jernmangel begrænser marine mikrober
- UV-lys behandler roesygdomme og bekæmper fungicideresistens
- Foreslåede standarder for triboelektriske nanogeneratorer kunne lette sammenligninger
- Forskere demonstrerer den første kemisk syntetiserede optiske switch
- Hvad er den lange revne, der dannes, når to tektoniske plader bevæger sig fra hinanden?


