Er det sandt, at hastigheden af en partikel kan påvirke, om flugtvæske?
* Fordampning: Når partikler inden for en væskeforstærkning nok kinetisk energi (på grund af varme), kan de overvinde de attraktive kræfter, der holder dem sammen og undslipper i gasfasen. Dette kaldes fordampning.
* damptryk: Fordampningshastigheden bestemmes af væskens damptryk. Damptryk er et mål for en væskens tendens til at fordampe.
* kogepunkt: Kogepunktet for en væske er den temperatur, hvormed dens damptryk er lig med det omgivende atmosfæriske tryk. På dette tidspunkt kan bobler af damp dannes inden for væsken og flygte.
Så det handler ikke om hastigheden på en enkelt partikel, men den gennemsnitlige kinetiske energi af partiklerne i væsken. En højere gennemsnitlig kinetisk energi betyder, at flere partikler har nok energi til at undslippe væsken, hvilket fører til hurtigere fordampning og et lavere kogepunkt.
Eksempel:
* Vand: Ved stuetemperatur har nogle vandmolekyler nok kinetisk energi til at undslippe væsken. Derfor kan du se vand, der fordampes, selvom det ikke koger.
* Opvarmningsvand: Hvis du opvarmer vand, øger du molekylernes gennemsnitlige kinetiske energi. Flere molekyler har nu nok energi til at flygte, hvilket fører til hurtigere fordampning. Når vandet når sit kogepunkt, er damptrykket lig med det atmosfæriske tryk, og vandet koger.
Kortfattet: Hastigheden af en enkelt partikel er mindre vigtig end den samlede kinetiske energi af partiklerne i væsken, som er påvirket af faktorer som temperatur og tryk.
 Varme artikler
Varme artikler
-
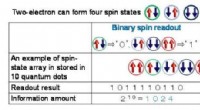 Samtidig påvisning af flere spin -tilstande i en enkelt kvantepunktEn sammenligning mellem binær spin -aflæsning og ternær spin -aflæsning. Kredit:Osaka University Quantum dots er meget små partikler, der udviser luminescens og elektroniske egenskaber, der adskil
Samtidig påvisning af flere spin -tilstande i en enkelt kvantepunktEn sammenligning mellem binær spin -aflæsning og ternær spin -aflæsning. Kredit:Osaka University Quantum dots er meget små partikler, der udviser luminescens og elektroniske egenskaber, der adskil -
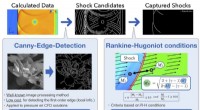 Forskere udvikler en samlet sensor til bedre at kontrollere virkningerne af chokbølgerEn ny billedbehandlingsproces giver mere nøjagtige resultater med lavere omkostninger. Kredit:Takeshi Fujimoto, Taro Kawasaki, og Keiichi Kitamura, Yokohama National University Når et jagerfly hur
Forskere udvikler en samlet sensor til bedre at kontrollere virkningerne af chokbølgerEn ny billedbehandlingsproces giver mere nøjagtige resultater med lavere omkostninger. Kredit:Takeshi Fujimoto, Taro Kawasaki, og Keiichi Kitamura, Yokohama National University Når et jagerfly hur -
 Wolfram for skørt til atomfusionsreaktorerKredit:University of Huddersfield Forskere ved University of Huddersfield har brugt nye faciliteter i verdensklasse til at udføre eksperimenter, der kunne hjælpe med udviklingen af kernefusionsr
Wolfram for skørt til atomfusionsreaktorerKredit:University of Huddersfield Forskere ved University of Huddersfield har brugt nye faciliteter i verdensklasse til at udføre eksperimenter, der kunne hjælpe med udviklingen af kernefusionsr -
 Myldretidsmetromængden styret af folks iver efter at tage hjemKredit:CC0 Public Domain Har du nogensinde fundet dig selv knust på en metrostation i myldretiden? Matematikeren Carlo Bianca og fysikeren Caterina Mogno, begge fra ingeniørforskningslaboratoriet
Myldretidsmetromængden styret af folks iver efter at tage hjemKredit:CC0 Public Domain Har du nogensinde fundet dig selv knust på en metrostation i myldretiden? Matematikeren Carlo Bianca og fysikeren Caterina Mogno, begge fra ingeniørforskningslaboratoriet
- Hvad er genefikation?
- Apps sender intime brugerdata til Facebook:rapporter
- Hvad er molmassen af en forbindelse, hvis 25,0 g opløst i 750 ml giver en molaritet på 0,290 M?
- Kulstof-kulstof kovalente bindinger langt mere fleksible end antaget
- Søger lydbølger i parameteren superfluid rækkefølge
- Højt ladede molekyler opfører sig paradoksalt


