Hvorfor er atommasse 10.82 og ikke 11?
* isotoper: Bor findes i naturen som to hovedisotoper:bor-10 og bor-11.
* bor-10 har 5 protoner og 5 neutroner, hvilket gør sin atommasse ca. 10.
* bor-11 har 5 protoner og 6 neutroner, hvilket gør sin atommasse ca. 11.
* overflod: Boron-11 er meget mere rigelig i naturen end Boron-10. Specifikt:
* Boron-10 udgør omkring 19,9% af naturligt forekommende bor.
* Boron-11 udgør ca. 80,1% af naturligt forekommende bor.
* Vægtet gennemsnit: Den atommasse, der er anført på den periodiske tabel, er et vægtet gennemsnit af masserne af isotoperne under hensyntagen til deres relative forekomst. Dette betyder:
* (Mass af bor-10 * Overflod af bor-10) + (masse af bor-11 *
* (10 * 0,199) + (11 * 0,801) = 10,82
Derfor er atommassen af bor 10,82, fordi den repræsenterer den gennemsnitlige masse af alle de naturligt forekommende boratomer i betragtning af de relative mængder af hver isotop.
Sidste artikelHvordan opnåede Erwin Schrodinger kvantemekanik?
Næste artikelHvad er forskellige former for lovbevægelse?
 Varme artikler
Varme artikler
-
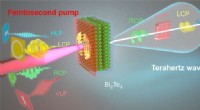 Afstembar THz-stråling fra 3-D topologisk isolatorGenerering af elliptisk og cirkulært polariserede terahertz-stråler. Kredit:Haihui Zhao et al., doi 10.1117/1.AP.2.6.066003 Terahertz (THz) bølger, placeret mellem millimeter- og fjerninfrarøde fr
Afstembar THz-stråling fra 3-D topologisk isolatorGenerering af elliptisk og cirkulært polariserede terahertz-stråler. Kredit:Haihui Zhao et al., doi 10.1117/1.AP.2.6.066003 Terahertz (THz) bølger, placeret mellem millimeter- og fjerninfrarøde fr -
 Eksperter udvikler en ny mekanisme, der kan fange submikron partikler på få minutterForskerne fandt ud af, at salt virkede på samme måde som en magnet. Kredit:Loughborough University En skefuld sukker kan få medicinen til at gå ned, men en ny Loughborough-ledet undersøgelse tyder
Eksperter udvikler en ny mekanisme, der kan fange submikron partikler på få minutterForskerne fandt ud af, at salt virkede på samme måde som en magnet. Kredit:Loughborough University En skefuld sukker kan få medicinen til at gå ned, men en ny Loughborough-ledet undersøgelse tyder -
 Eksperimenter påviser entropiproduktion i mesoskopiske kvantesystemerIllustration af en stationær tilstand, der opnås, når to kvanteharmoniske oscillatorer (i grønt) er koblet til to varmebade ved forskellige temperaturer. I dette tilfælde, en strøm af varme vil strømm
Eksperimenter påviser entropiproduktion i mesoskopiske kvantesystemerIllustration af en stationær tilstand, der opnås, når to kvanteharmoniske oscillatorer (i grønt) er koblet til to varmebade ved forskellige temperaturer. I dette tilfælde, en strøm af varme vil strømm -
 Kvantovergang får elektroner til at opføre sig som om de mangler spinKredit:FAPESP De fælles faseovergange er dem, der opstår som en funktion af temperaturvariation. Is ændrer fase til at blive flydende vand ved 0 grader Celsius. Flydende vand ændrer fase til vandd
Kvantovergang får elektroner til at opføre sig som om de mangler spinKredit:FAPESP De fælles faseovergange er dem, der opstår som en funktion af temperaturvariation. Is ændrer fase til at blive flydende vand ved 0 grader Celsius. Flydende vand ændrer fase til vandd
- Etablering af oprindelsen til solmasser sorte huller og forbindelsen til mørkt stof
- Når to ulige kræfter virker i modsatte retninger på et objekt i bevægelse, hvad vil det gøre?
- Hvad er en Catayst?
- Hvordan bruger du ordet videnskabsmand i en sætning?
- Heartbeat-stjerner låst op i ny undersøgelse
- Frankrig vil pumpe 65 millioner euro til afrikanske startups


