Hvad er fysisk tilstand?
solid:
* Fast form og volumen: Faststoffer opretholder deres form og volumen uanset deres beholder.
* Stærke intermolekylære kræfter: Partiklerne i et fast stof er tæt pakket sammen og tiltrukket sig stærkt af hinanden.
* Begrænset bevægelse: Partiklerne i et fast stof kan kun vibrere i faste positioner.
* Eksempler: Is, sten, træ, metal.
væske:
* fast volumen, men variabel form: Væsker opretholder deres volumen, men tager formen på deres beholder.
* svagere intermolekylære kræfter end faste stoffer: Partiklerne i en væske er stadig tæt på hinanden, men har mere frihed til at bevæge sig rundt.
* Moderat bevægelse: Partikler i en væske kan bevæge sig rundt og glide forbi hinanden.
* Eksempler: Vand, olie, juice, kviksølv.
gas:
* Ingen fast form eller volumen: Gasser udvides for at fylde hele beholderen, de besætter.
* svageste intermolekylære kræfter: Partiklerne i en gas er langt fra hinanden og har minimal tiltrækning til hinanden.
* Høj bevægelse: Partiklerne i en gas bevæger sig frit og hurtigt i alle retninger.
* Eksempler: Luft, ilt, kuldioxid, helium.
Faktorer, der påvirker fysisk tilstand:
* Temperatur: Forøgelse af temperaturen øger generelt energien fra partikler, hvilket får dem til at bevæge sig mere frit og overgang fra fast til væske (smelte) eller fra væske til gas (kogning/fordampning).
* tryk: Stigende tryk tvinger generelt partikler tættere sammen og favoriserer væsken eller fast tilstand.
Andre tilstande af stof:
* plasma: En ioniseret gas, der findes i stjerner og fluorescerende lys.
* bose-einstein kondensat: En tilstand af stof, hvor atomer afkøles til næsten absolut nul og opfører sig som en enkelt enhed.
Den fysiske tilstand af et stof er en vigtig egenskab, der påvirker dets opførsel og egenskaber. At forstå forskellene mellem faste stoffer, væsker og gasser er afgørende inden for mange videnskabelige felter.
Sidste artikelBevæger partikler sig i forskellige retninger?
Næste artikelHvad er de vigtige obligatoriske problemer i fysik for STD 12.?
 Varme artikler
Varme artikler
-
 Mikroskop ved hjælp af UV i stedet for synligt lys, der dukker op som diagnostisk værktøjMUSE -teknologi fanger brystvæv med nerve, der strømmer over og gennem et lag intakte fedtceller. Kredit:Richard Levenson, UC Davis MUSE-billede af talgkirtlen Et mikroskop ved hjælp af ultraviole
Mikroskop ved hjælp af UV i stedet for synligt lys, der dukker op som diagnostisk værktøjMUSE -teknologi fanger brystvæv med nerve, der strømmer over og gennem et lag intakte fedtceller. Kredit:Richard Levenson, UC Davis MUSE-billede af talgkirtlen Et mikroskop ved hjælp af ultraviole -
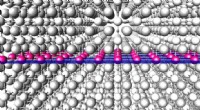 Electron sandwich fordobler termoelektrisk ydeevneKonceptuel tegning af supergitteret, hvor spredte elektroner er begrænset til et snævert rum for at forbedre termoelektrisk omdannelse. Kredit:Hokkaido University Forskere mere end fordoblede et m
Electron sandwich fordobler termoelektrisk ydeevneKonceptuel tegning af supergitteret, hvor spredte elektroner er begrænset til et snævert rum for at forbedre termoelektrisk omdannelse. Kredit:Hokkaido University Forskere mere end fordoblede et m -
 Kongepingvins avlskolonier er struktureret som væskerEn kongepingvin avlskoloni på Possession Island, Crozet øhav. Kredit:Céline Le Bohec (CNRS / IPEV / CSM) Kolonier af avlskongpingviner opfører sig meget som partikler i væsker gør, ifølge en ny un
Kongepingvins avlskolonier er struktureret som væskerEn kongepingvin avlskoloni på Possession Island, Crozet øhav. Kredit:Céline Le Bohec (CNRS / IPEV / CSM) Kolonier af avlskongpingviner opfører sig meget som partikler i væsker gør, ifølge en ny un -
 Ny optisk hukommelsescelle opnår tæthed for lagring af datalagringKredit:Petr Kratochvil/public domain Forskere har demonstreret en ny teknik, der kan lagre flere optiske data i et mindre rum, end det tidligere var muligt på chip. Denne teknik forbedrer fasefora
Ny optisk hukommelsescelle opnår tæthed for lagring af datalagringKredit:Petr Kratochvil/public domain Forskere har demonstreret en ny teknik, der kan lagre flere optiske data i et mindre rum, end det tidligere var muligt på chip. Denne teknik forbedrer fasefora


