Hvilken model bruger forskere til at tale om bane af elektroner i et atom?
1. Bohr Model: Denne model, foreslået af Niels Bohr i 1913, er en forenklet model, der skildrer elektroner, der kredser om kernen i faste, cirkulære stier kaldet kredsløb. Det er en nyttig måde at visualisere elektronadfærd på, men det har begrænsninger, da det ikke fuldt ud forklarer elektronernes komplekse karakter.
2. Kvantemekanisk model: Dette er den mere nøjagtige og komplekse model. Den beskriver elektroner, der ikke er som kredsende partikler, men som sandsynlighedsfordelinger inden for regioner kaldet orbitaler . Disse orbitaler er tredimensionelle rum, hvor der er stor sandsynlighed for at finde en elektron. Denne model er baseret på ideen om, at elektroner har bølglignende egenskaber og deres nøjagtige placering kan ikke bestemmes nøjagtigt.
Så svaret er: Forskere bruger primært kvantemekanisk model At tale om opførsel af elektroner i atomer. De kan dog også bruge bohr -modellen Som en forenklet måde at visualisere begrebet elektronkrav, især i indledende diskussioner.
Sidste artikelHvad gør en videnskabelig idélov?
Næste artikelHvor mange newtoner i et kilogram?
 Varme artikler
Varme artikler
-
 Forskere kvantificerer faktorer for at reducere effekt halvlederresistens med to tredjedeleElektronspredning under siliciumcarbid (SiC) -grænsefladen er begrænset af tre faktorer:ruheden i SiC -grænsefladen, ladninger under SiC -grænsefladen og atomvibrationer. Kredit:Mitsubishi Electric Co
Forskere kvantificerer faktorer for at reducere effekt halvlederresistens med to tredjedeleElektronspredning under siliciumcarbid (SiC) -grænsefladen er begrænset af tre faktorer:ruheden i SiC -grænsefladen, ladninger under SiC -grænsefladen og atomvibrationer. Kredit:Mitsubishi Electric Co -
 Fysikere opdager, at nogle plasma-ustabiliteter kan slukke sig selvPPPL-fysiker Fatima Ebrahimi. Kredit:Elle Starkman Fysiker Fatima Ebrahimi ved det amerikanske energiministeriums (DOE) Princeton Plasma Physics Laboratory (PPPL) har for første gang brugt avancer
Fysikere opdager, at nogle plasma-ustabiliteter kan slukke sig selvPPPL-fysiker Fatima Ebrahimi. Kredit:Elle Starkman Fysiker Fatima Ebrahimi ved det amerikanske energiministeriums (DOE) Princeton Plasma Physics Laboratory (PPPL) har for første gang brugt avancer -
 Wave beams blander og omrører havet for at skabe klimaθ), (b) kritisk (φ =θ), og (c) subkritisk (φ <θ) kontinentalsokkel skråninger. Bjælkerne er markeret med de sorte og magenta pile, der udsendes fra forskellige energikilder (sorte og magentapunkter).
Wave beams blander og omrører havet for at skabe klimaθ), (b) kritisk (φ =θ), og (c) subkritisk (φ <θ) kontinentalsokkel skråninger. Bjælkerne er markeret med de sorte og magenta pile, der udsendes fra forskellige energikilder (sorte og magentapunkter). -
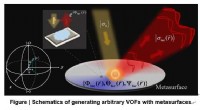 Effektive generationer af komplekse vektorielle optiske felter med metasurfacesKredit:Dongyi Wang, Feifei Liu, Tong Liu, Shulin Sun, Qiong He og Lei Zhou Vektorielle optiske felter (VOFer), der udviser vilkårligt designede bølgefronter og polarisationsfordelinger, er meget ø
Effektive generationer af komplekse vektorielle optiske felter med metasurfacesKredit:Dongyi Wang, Feifei Liu, Tong Liu, Shulin Sun, Qiong He og Lei Zhou Vektorielle optiske felter (VOFer), der udviser vilkårligt designede bølgefronter og polarisationsfordelinger, er meget ø


