Hvordan ser brintmodellen ud?
1. Bohr -modellen (1913):
* Visual: Denne model er den mest ikoniske og bruges ofte til at skildre atomet. Det viser en central kerne (der indeholder en enkelt proton) med en elektron, der kredserer den på en cirkulær sti.
* Begrænsninger: Dette er en forenklet model og repræsenterer ikke fuldt ud elektronens kvante karakter. Det forudsiger ikke nøjagtigt elektronens energier eller sandsynligheden for dets placering.
2. The Quantum Mechanical Model (1926):
* Visual: Denne model giver ikke en klar visuel repræsentation af elektronens sti. Det fokuserer på elektronens sandsynlighed for at være på et specifikt tidspunkt i rummet.
* Repræsentation: Vi bruger elektronskyer eller orbitaler til at vise sandsynlighedsfordelingen af elektronet omkring kernen. Jo tættere skyen er, jo højere er sandsynligheden for at finde elektronet i denne region.
* for brint: Den enkleste orbital, kaldet 1s orbital, er en sfærisk sky, der omgiver kernen.
3. Forenklede repræsentationer:
* en simpel kerne med en prik, der repræsenterer elektronet: Dette understreger kernen og elektronens eksistens uden at komme ind i komplekse orbitaldetaljer.
* en kerne med en cirkel, der omgiver den: Dette er en grundlæggende repræsentation af elektronskyen uden at skildre dens specifikke form.
hvilken model skal du bruge?
Valget af model afhænger af formålet. BoHR -modellen er nyttig til grundlæggende forklaringer, mens den kvantemekaniske model giver et mere nøjagtigt billede af atomets opførsel.
nøglepunkter at huske:
* Hydrogenatomet har kun en proton og en elektron.
* Elektronet følger ikke en bestemt sti, men findes i en skylignende region omkring kernen.
* Den kvantemekaniske model er den mest nøjagtige repræsentation af brintatomet.
Fortæl mig, hvis du gerne vil have mig til at uddybe en bestemt model!
 Varme artikler
Varme artikler
-
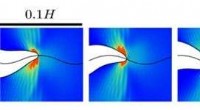 Hvad sker der ved den bevægelige kant af en revne?Sporet af en revnespids, viser en svingningscyklus. Den vandrette bølgede linje viser banen for spidsens spids. Kredit:Weizmann Institute of Science Det siges, at et svagt led bestemmer styrken af
Hvad sker der ved den bevægelige kant af en revne?Sporet af en revnespids, viser en svingningscyklus. Den vandrette bølgede linje viser banen for spidsens spids. Kredit:Weizmann Institute of Science Det siges, at et svagt led bestemmer styrken af -
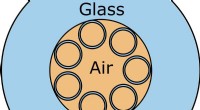 Anti-resonans optisk fiber med hul kerne reducerer støjDen anti-resonante hule kernefiber har et unikt arrangement af syv hule kapillærer arrangeret omkring en hul kerne inde i fiberen. Kredit:Arjun Iyer/Renninger lab/University of Rochester En ny hul
Anti-resonans optisk fiber med hul kerne reducerer støjDen anti-resonante hule kernefiber har et unikt arrangement af syv hule kapillærer arrangeret omkring en hul kerne inde i fiberen. Kredit:Arjun Iyer/Renninger lab/University of Rochester En ny hul -
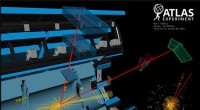 LHC skaber stof ud fra lysEn ATLAS -begivenhedsvisning i 2018 i overensstemmelse med produktionen af et par W bosoner fra to fotoner, og det efterfølgende henfald af W-bosonerne til en myon og en elektron (synlig i detektore
LHC skaber stof ud fra lysEn ATLAS -begivenhedsvisning i 2018 i overensstemmelse med produktionen af et par W bosoner fra to fotoner, og det efterfølgende henfald af W-bosonerne til en myon og en elektron (synlig i detektore -
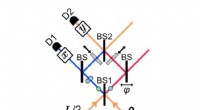 Fysikere måler komplementære egenskaber ved hjælp af kvanteklonerSkematisk af den eksperimentelle opsætning, hvor komplementære egenskaber x og y måles i fællesskab. Kredit:Thekkadath et al. © 2017 American Physical Society (Phys.org) - I kvantemekanik, det er
Fysikere måler komplementære egenskaber ved hjælp af kvanteklonerSkematisk af den eksperimentelle opsætning, hvor komplementære egenskaber x og y måles i fællesskab. Kredit:Thekkadath et al. © 2017 American Physical Society (Phys.org) - I kvantemekanik, det er
- Sætter hybrid-elektriske flys ydeevne på prøve
- Facebook indgav patent på omgivende lydsystem:Glæd dig over, at de sagde, at de ikke vil bruge det
- Minimering af brændstofeksplosioner og brande fra ulykker og terrorhandlinger med polymerer
- Hadefulde ytringer er stadig nemme at finde på sociale medier
- Hvilken slags energi gemmes i nogen komprimerede eller strakte genstande?
- Hvilken uddannelse har biokemikere brug for?


