Måler temperaturen, hvor hurtigt et stofs partikler bevæger sig rundt?
Temperatur er direkte relateret til den gennemsnitlige kinetiske energi af partiklerne i et stof. Kinetisk energi er bevægelsesenergien. Så jo hurtigere partiklerne bevæger sig, jo højere er den gennemsnitlige kinetiske energi, og jo højere er temperaturen.
Her er en sammenbrud:
* faste stoffer: Partikler i faste stoffer er tæt pakket og vibrerer på plads. Jo højere temperatur, jo mere kraftigt vibrerer de.
* væsker: Partikler i væsker har mere frihed til at bevæge sig rundt. De glider forbi hinanden, og jo højere temperatur, jo hurtigere bevæger de sig.
* Gasser: Partikler i gasser er langt fra hinanden og bevæger sig meget hurtigt i alle retninger. Jo højere temperatur, jo hurtigere bevæger de sig, og jo flere kollisioner har de.
Vigtig note: Temperatur måler den gennemsnitlige kinetiske energi. Dette betyder, at selv ved en bestemt temperatur vil der være en række hastigheder blandt partiklerne. Nogle vil bevæge sig hurtigere, nogle langsommere.
 Varme artikler
Varme artikler
-
 Fysikere bidrager til detektorsucces for mørkt stofStuderende Arthur Kurlej svejser gitterelektroden på dens støttering inde i det radon-undertrykte renrum i det underjordiske laboratorium på Gran Sasso, Italien. Kurlejs rådgiver, fysikprofessor Andre
Fysikere bidrager til detektorsucces for mørkt stofStuderende Arthur Kurlej svejser gitterelektroden på dens støttering inde i det radon-undertrykte renrum i det underjordiske laboratorium på Gran Sasso, Italien. Kurlejs rådgiver, fysikprofessor Andre -
 Forskere skaber smukke ægteskaber af kvantefjenderPh.d.-studerende Phillip Dang (til venstre) og Reet Chaudhuri ved National High Magnetic Field Laboratory, hvor der blev foretaget målinger på en materialestruktur, der samtidig har superledning og kv
Forskere skaber smukke ægteskaber af kvantefjenderPh.d.-studerende Phillip Dang (til venstre) og Reet Chaudhuri ved National High Magnetic Field Laboratory, hvor der blev foretaget målinger på en materialestruktur, der samtidig har superledning og kv -
 At gå ud over antilaseren muliggør muligvis langtrækkende trådløs strømoverførselBuer af elektricitet genereret af en Tesla-spole. Kredit:Airarcs/CC BY-SA 3.0 Lige siden Nikola Tesla udspøjede elektricitet i alle retninger med sin spole tilbage i 1891, forskere har tænkt på må
At gå ud over antilaseren muliggør muligvis langtrækkende trådløs strømoverførselBuer af elektricitet genereret af en Tesla-spole. Kredit:Airarcs/CC BY-SA 3.0 Lige siden Nikola Tesla udspøjede elektricitet i alle retninger med sin spole tilbage i 1891, forskere har tænkt på må -
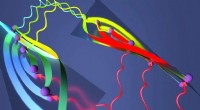 Fysikere åbner døren til den første direkte måling af Berry -krumning i fast stofDenne kunstners gengivelse indeholder Berry -krumning repræsenteret af de snoede bånd øverst. Kredit:Brian Long Berry krumning er måske ikke det mest velkendte videnskabelige koncept, men for mang
Fysikere åbner døren til den første direkte måling af Berry -krumning i fast stofDenne kunstners gengivelse indeholder Berry -krumning repræsenteret af de snoede bånd øverst. Kredit:Brian Long Berry krumning er måske ikke det mest velkendte videnskabelige koncept, men for mang
- Levering af kræft-billeddannende isotoper af høj kvalitet
- Hvordan klassificeres klipper i en af disse tre grupper?
- Topologi bliver magnetisk:Den nye bølge af topologiske magnetiske materialer
- Hvilken videnskabsmand opdagede lyd energi varme eller lysenergi?
- Er opslagstavler ledere eller isolatorer?
- Er det spild af energi at køre hjem i luften conditioer med vinduerne åbne, hvis udetemperaturen e…


