Hvilken slags kraft virker med i et molekyle?
1. intramolekylære kræfter: Dette er de kræfter, der holder atomer sammen i et molekyle. De er meget stærkere end intermolekylære kræfter.
* kovalente obligationer: Den stærkeste type intramolekylær kraft. De involverer deling af elektroner mellem atomer. Eksempler inkluderer bindingerne i vand (H₂O) og metan (CH₄).
* ioniske bindinger: Disse involverer den elektrostatiske tiltrækning mellem modsat ladede ioner. De findes typisk ikke inden for molekyler, men snarere mellem molekyler i ioniske forbindelser.
* Metalliske obligationer: Disse forekommer i metaller og involverer et "hav" af delokaliserede elektroner, der deles af alle metalatomer.
2. Intermolekylære kræfter: Dette er de kræfter, der findes * mellem * molekyler. De er meget svagere end intramolekylære kræfter, men spiller stadig en betydelig rolle i bestemmelsen af et stofs fysiske egenskaber, såsom smeltepunkt og kogepunkt.
* Hydrogenbinding: En stærk type dipol-dipolinteraktion, der opstår, når et hydrogenatom er bundet til et stærkt elektronegativt atom, såsom ilt eller nitrogen. Dette er afgørende for vandets egenskaber.
* dipol-dipolinteraktioner: Forekommer mellem polære molekyler på grund af tiltrækningen af modsat ladede ender.
* London Dispersion Forces: Dette er midlertidige, svage attraktioner, der forekommer mellem alle molekyler på grund af øjeblikkelige udsving i elektronfordeling. De er den svageste intermolekylære kraft.
For at opsummere, de kræfter, der holder et molekyle sammen kaldes intramolekylære kræfter , hovedsageligt kovalente obligationer . De kræfter, der handler mellem molekyler kaldes intermolekylære kræfter , som er meget svagere og inkluderer hydrogenbinding, dipol-dipol-interaktioner og London-spredningskræfter .
 Varme artikler
Varme artikler
-
 Overførsel af et domænemønster mellem magnetisering og elektrisk polariseringsrum opnået for fø…Magnetoelektrisk domæneoverførsel. Anvendelsen af et magnetfelt oversætter et magnetisk domænemønster til et ferroelektrisk mønster, mens det samtidig slettes i den magnetiske tilstand. Et elektrisk
Overførsel af et domænemønster mellem magnetisering og elektrisk polariseringsrum opnået for fø…Magnetoelektrisk domæneoverførsel. Anvendelsen af et magnetfelt oversætter et magnetisk domænemønster til et ferroelektrisk mønster, mens det samtidig slettes i den magnetiske tilstand. Et elektrisk -
 Sigter mod et mål:videnskaben om partikelproduktionDet højenergiske NOvA-mål på Fermilab er lavet af høje grafitfinner, stillet op som dominobrikker, vist her inde i dens vandkølede ydre kar. Kredit:Patrick Hurh For nogle, et mål er en del af et s
Sigter mod et mål:videnskaben om partikelproduktionDet højenergiske NOvA-mål på Fermilab er lavet af høje grafitfinner, stillet op som dominobrikker, vist her inde i dens vandkølede ydre kar. Kredit:Patrick Hurh For nogle, et mål er en del af et s -
 Kvantekompas kunne tillade navigation uden at stole på satellitterNærbillede af accelerometeret. Kredit:Imperial College London Storbritanniens første kvanteaccelerometer til navigation er blevet demonstreret af et team fra Imperial College London og M Squared.
Kvantekompas kunne tillade navigation uden at stole på satellitterNærbillede af accelerometeret. Kredit:Imperial College London Storbritanniens første kvanteaccelerometer til navigation er blevet demonstreret af et team fra Imperial College London og M Squared. -
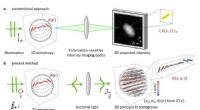 Tomografisk måling af dielektriske tensorerEn 3D anisotropisk prøve belyses af polariseret lys (P), og dens 2D-billeder optages efter at have passeret gennem analysatoren (A). Denne 2D-polarisationsfølsomme billeddannelse skjuler især den aksi
Tomografisk måling af dielektriske tensorerEn 3D anisotropisk prøve belyses af polariseret lys (P), og dens 2D-billeder optages efter at have passeret gennem analysatoren (A). Denne 2D-polarisationsfølsomme billeddannelse skjuler især den aksi
- Er liv mere sandsynligt end sorte huller til at være en tilpasning til universets replikation?
- Hvordan kan du fortælle, at den kinetiske energi falder, når jonglerpin stiger?
- Hvad er koefficienten for termisk ekspansion benzin?
- Chipopgradering hjælper miniaturedroner med at navigere
- Forskere udfører kemisk undersøgelse af en gammel, metalrig kuglehob
- Kan en mængde have enheder, men stadig være dimensionsløs?


