Hvordan er det muligt for to atomer af det samme element at have forskellige masser?
Her er en sammenbrud:
* atomer: De grundlæggende byggesten af stof, sammensat af protoner, neutroner og elektroner.
* Element: Et stof, der kun består af en type atom, defineret af dets antal protoner (atomnummer).
* isotoper: Atomer med det samme element, der har det samme antal protoner, men forskellige antal neutroner.
Da neutroner har masse, adskiller isotoper af det samme element sig i deres atommasse . Dette skyldes, at massen af et atom primært bestemmes af antallet af protoner og neutroner i dens kerne.
Eksempel:
* Carbon-12 (¹²C) har 6 protoner og 6 neutroner.
* Carbon-14 (¹⁴c) har 6 protoner og 8 neutroner.
Begge er carbonatomer, men ¹⁴C er tungere på grund af de ekstra neutroner.
Nøglepunkter:
* atomnummer bestemmer elementet.
* massenummer (Antal protoner + neutroner) bestemmer isotopen.
* Tilstedeværelsen af isotoper forklarer, hvorfor atommassen af et element på den periodiske tabel ikke er et helt tal. Det er et gennemsnit af masserne af alle naturligt forekommende isotoper af dette element.
Afslutningsvis fører variationen i neutronantal inden for isotoper af det samme element til forskellige atommasser, selvom elementerne i sig selv er defineret af deres konsistente antal protoner.
Sidste artikelNår en kraft på et objekt øges, hvordan ændres accelerationen?
Næste artikelHvad er den fysiske ændring af en tennisbold?
 Varme artikler
Varme artikler
-
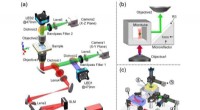 Samtidig optisk fangst og billeddannelse i det aksiale plan for lys-stof-interaktionSkematisk af den samtidige optiske fangst og fluorescerende billeddannelse i det aksiale plan. Kredit:XIOPM Optisk fangst er blevet et stærkt værktøj inden for mange områder som biologi, fysik, ke
Samtidig optisk fangst og billeddannelse i det aksiale plan for lys-stof-interaktionSkematisk af den samtidige optiske fangst og fluorescerende billeddannelse i det aksiale plan. Kredit:XIOPM Optisk fangst er blevet et stærkt værktøj inden for mange områder som biologi, fysik, ke -
 Når laserstråler møder plasma:Nye data adresserer hul i fusionsforskningForskere brugte Omega Laser Facility på Rochesters Laboratory for Laser Energetics til at foretage meget detaljerede målinger af laseropvarmede plasmaer. Kredit:Universitetsfoto / J. Adam Fenster
Når laserstråler møder plasma:Nye data adresserer hul i fusionsforskningForskere brugte Omega Laser Facility på Rochesters Laboratory for Laser Energetics til at foretage meget detaljerede målinger af laseropvarmede plasmaer. Kredit:Universitetsfoto / J. Adam Fenster -
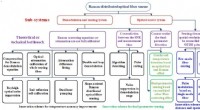 Fysik og anvendelser af Raman-distribueret optisk fibersensorI dette diagram repræsenterer de røde ord undersystemerne. De sorte ord repræsenterer optimeringsskemaet for temperaturmålingsnøjagtighed, de blå ord repræsenterer optimeringsskemaet for sansning af a
Fysik og anvendelser af Raman-distribueret optisk fibersensorI dette diagram repræsenterer de røde ord undersystemerne. De sorte ord repræsenterer optimeringsskemaet for temperaturmålingsnøjagtighed, de blå ord repræsenterer optimeringsskemaet for sansning af a -
 Kvantemaskine viser løfte om biologisk forskningKredit:CC0 Public Domain Til dato, meget er blevet udtalt om løftet om kvanteberegning til utallige applikationer, men der har været få eksempler på en kvantefordel for virkelige problemer af prak
Kvantemaskine viser løfte om biologisk forskningKredit:CC0 Public Domain Til dato, meget er blevet udtalt om løftet om kvanteberegning til utallige applikationer, men der har været få eksempler på en kvantefordel for virkelige problemer af prak
- Hvorfor er elektricitet så vigtig for moderne mennesker?
- Hvordan laver man en RNA & en DNA-model
- Hvad er den kinetiske energi i Joules på en 0,02 kg kugle, der kører 300 miles i sekundet?
- Er kraft og bevægelse ens eller forskellige?
- George Laurer, opfinder af allestedsnærværende UPC, dør som 94-årig
- Sprænge skyerne for bedre kommunikation


