Hvornår bevæger molekyler sig hurtigere?
* temperatur er højere: Jo højere temperatur er, jo mere kinetisk energi har molekylerne, og jo hurtigere bevæger de sig. Tænk på en varm kop kaffe:Molekylerne surrer mere kraftigt rundt end i en kold kop.
* masse er lavere: Lysere molekyler bevæger sig hurtigere end tungere ved den samme temperatur. Tænk på en ping pong -bold og en bowlingkugle. Hvis du giver dem det samme skub, rejser Ping Pong Ball meget hurtigere.
* trykket er højere: I gasser betyder højere tryk, at molekylerne kolliderer oftere, hvilket fører til højere gennemsnitlig kinetisk energi og derfor hurtigere bevægelse.
Her er en sammenbrud af, hvorfor disse faktorer påvirker molekylær hastighed:
Temperatur: Temperaturen er et mål for den gennemsnitlige kinetiske energi af molekyler. Mere kinetisk energi betyder, at molekylerne bevæger sig hurtigere.
Masse: Et molekyle kinetiske energi er direkte proportional med dens masse og kvadratet af dens hastighed. Dette betyder, at for den samme mængde kinetisk energi vil lettere molekyler bevæge sig hurtigere.
tryk: I gasser betyder højere tryk, at molekylerne er pakket tættere sammen og kolliderer oftere. Disse kollisioner overfører energi, hvilket øger den gennemsnitlige kinetiske energi og molekylernes hastighed.
Vigtig note: Dette er generelle tendenser. Der er situationer, hvor andre faktorer kan påvirke molekylær hastighed, såsom tilstedeværelsen af stærke intermolekylære kræfter.
 Varme artikler
Varme artikler
-
 Ultrakølede atomer kunne give 2-D vindue til eksotisk 1-D fysikI et ultrakoldt atomeksperiment foreslået af Rice Universitys fysikere Matthew Foster og Seth Davis, kvantefraktionalisering ville blive observeret ved densitetsbølger, der formerer sig i retning af 1
Ultrakølede atomer kunne give 2-D vindue til eksotisk 1-D fysikI et ultrakoldt atomeksperiment foreslået af Rice Universitys fysikere Matthew Foster og Seth Davis, kvantefraktionalisering ville blive observeret ved densitetsbølger, der formerer sig i retning af 1 -
 Forskere introducerer fremtidens magnetiske datalagringKredit:ktsdesign, Shutterstock Enkeltmolekylmagneter (SMMer) har tiltrukket megen opmærksomhed for nylig. Dette skyldes den øgede efterspørgsel efter hurtigere, længerevarende og lavere energi-it-
Forskere introducerer fremtidens magnetiske datalagringKredit:ktsdesign, Shutterstock Enkeltmolekylmagneter (SMMer) har tiltrukket megen opmærksomhed for nylig. Dette skyldes den øgede efterspørgsel efter hurtigere, længerevarende og lavere energi-it- -
 Molekylære danse bestemmer, hvordan væsker optager varmeKredit:CC0 Public Domain Forskere har afdækket en forbindelse mellem de mikroskopiske bevægelser af partikler i en væske og dets evne til at absorbere varme. Når en væske opvarmes, begynder molek
Molekylære danse bestemmer, hvordan væsker optager varmeKredit:CC0 Public Domain Forskere har afdækket en forbindelse mellem de mikroskopiske bevægelser af partikler i en væske og dets evne til at absorbere varme. Når en væske opvarmes, begynder molek -
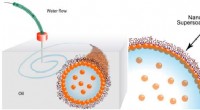 Forskere udskriver alle-flydende 3D-strukturerDisse skemaer viser trykning af vand i olie ved hjælp af en nanopartikels supersæbe. Guldnanopartikler i vandet kombineres med polymerligander i olien for at danne en elastisk film (nanopartikelsupper
Forskere udskriver alle-flydende 3D-strukturerDisse skemaer viser trykning af vand i olie ved hjælp af en nanopartikels supersæbe. Guldnanopartikler i vandet kombineres med polymerligander i olien for at danne en elastisk film (nanopartikelsupper
- Sammensætningen af gamle meteoritter
- Fleksibel film kan føre til kræftdetektor i telefonstørrelse
- Denne hvide maling holder overflader køligere end omgivelserne, selv under direkte sollys
- USA kan få en forårsferie på vejret. Prognosefolk ser minimale oversvømmelser og tørke til forå…
- Hvad er synonymer for kinetisk energi?
- Hvad producerer både lys og varmeenergi?


