En forklaring på, hvordan partikler i stof opfører sig, kaldes?
Her er en sammenbrud:
* kinetisk henviser til bevægelse eller bevægelsesenergi.
* molekylær Angiver, at teorien fokuserer på molekylernes opførsel, som er de mindste enheder af et stof, der bevarer dets kemiske egenskaber.
* teori betyder, at det er en godt understøttet forklaring baseret på observationer og eksperimenter, dog ikke en endelig lov.
Den kinetiske molekylære teori skitserer følgende nøglepunkter om partikeladfærd:
* Konstant bevægelse: Partikler i stof er altid i bevægelse, selv i faste stoffer.
* Kollisioner: Partikler kolliderer med hinanden og væggene i deres beholder.
* Temperatur og energi: Den gennemsnitlige kinetiske energi af partikler er direkte proportional med temperaturen på stoffet.
* Stater af stof: Materialet (fast, flydende, gas) bestemmes af styrken af kræfterne mellem partikler og deres gennemsnitlige kinetiske energi.
At forstå den kinetiske molekylære teori hjælper os med at forklare mange fysiske fænomener, såsom:
* Udvidelse af gasser: Når de opvarmes, bevæger gaspartikler sig hurtigere og kolliderer oftere, hvilket fører til en stigning i volumen.
* diffusion: Partikler i væsker og gasser spredt ud på grund af deres tilfældige bevægelse.
* Fordampning: Flydende partikler med nok kinetisk energi kan flygte ind i gasfasen.
Så selvom det måske ikke er et enkelt ord, er den kinetiske molekylære teori den omfattende forklaring på, hvordan partikler i stof opfører sig.
 Varme artikler
Varme artikler
-
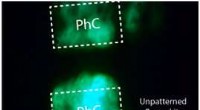 Lysende perovskit -lysdioder med fotoniske krystallerFig. 1 Fotoluminescensbillede af fotonisk krystal (PhC) og umønstret perovskit tynd film. Kredit:Nanyang Technological University Alle uorganiske cesium blyhalogenidperovskit halvledere udviser st
Lysende perovskit -lysdioder med fotoniske krystallerFig. 1 Fotoluminescensbillede af fotonisk krystal (PhC) og umønstret perovskit tynd film. Kredit:Nanyang Technological University Alle uorganiske cesium blyhalogenidperovskit halvledere udviser st -
 Polarisationsskift på flere niveauer i ferroelektriske tynde filmDannelse af nanoskala 180° domæner i anstrengt PZTMPB tynde film. en ISHG-signaludvikling under den igangværende vækst af PZTMPB på SRO-buffer NSO (røde symboler) og ved standset vækst (sorte symboler
Polarisationsskift på flere niveauer i ferroelektriske tynde filmDannelse af nanoskala 180° domæner i anstrengt PZTMPB tynde film. en ISHG-signaludvikling under den igangværende vækst af PZTMPB på SRO-buffer NSO (røde symboler) og ved standset vækst (sorte symboler -
 Nanoteknologieksperter opretter den første optiske kontakt med terahertz-hastighed-polariseringTidligere Sandia National Laboratories postdoktorforsker Yuanmu Yang, venstre, og Sandia -forskeren Igal Brener satte sig for at lave test i et optisk laboratorium. Et hold ledet af Brener udgav en N
Nanoteknologieksperter opretter den første optiske kontakt med terahertz-hastighed-polariseringTidligere Sandia National Laboratories postdoktorforsker Yuanmu Yang, venstre, og Sandia -forskeren Igal Brener satte sig for at lave test i et optisk laboratorium. Et hold ledet af Brener udgav en N -
 Gel medvirkende til 3-D bioprinting af biologiske vævBioprintning af mesenkymale stamcellesfæroider i form af helix i en udbyttestress-gel. Kredit:Ozbolat Lab i Penn State Den endelige skabelse af udskiftning af biologiske dele kræver fuldt ud tredi
Gel medvirkende til 3-D bioprinting af biologiske vævBioprintning af mesenkymale stamcellesfæroider i form af helix i en udbyttestress-gel. Kredit:Ozbolat Lab i Penn State Den endelige skabelse af udskiftning af biologiske dele kræver fuldt ud tredi
- Cassini, Voyager-missioner foreslår et nyt billede af solens interaktion med galaksen
- Hvordan bruger du astrolog i en sætning?
- Qualcomm anmoder om national sikkerhedsgennemgang af Broadcom-buddet
- Hvorfor er yttrium vigtigt?
- Hvad er masseplacering og ladning af atomiske subpartikler?
- Fox og NBCUniversal i forhandlinger om at erhverve streamingplatforme:rapport


