Hvilken kraft er ansvarlig for at give en solid form?
Her er hvorfor:
* Intermolekylære kræfter er de attraktive kræfter mellem molekyler. I faste stoffer er disse kræfter stærke nok til at holde molekylerne i et fast, stift arrangement.
* Stærke intermolekylære kræfter Ligesom hydrogenbinding er dipol-dipol-interaktioner og London-spredningskræfter ansvarlige for den stive struktur af faste stoffer.
* styrken af disse kræfter bestemmer det faste stof og smeltepunkt for det faste stof.
Tænk på det sådan:Forestil dig en flok mennesker, der holder hænderne tæt. Det er som de intermolekylære kræfter, der holder molekyler sammen i et fast stof. De opretholder formen og forhindrer, at det faste stof let ændrer sin form.
Fortæl mig, hvis du gerne vil have flere detaljer om de forskellige typer intermolekylære kræfter!
Sidste artikelÆndrer et skråt plan kraftretningsretningen?
Næste artikelHvad er bølgelængden på 42800 Hz?
 Varme artikler
Varme artikler
-
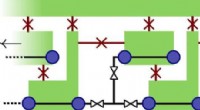 Nyt kvantecomputerdesign til at forudsige molekyleegenskaberKredit:Leiden Institute of Physics Standardmetoden til at bygge en kvantecomputer med majoranas som byggesten er at konvertere dem til qubits. Imidlertid, en lovende anvendelse af kvanteberegning
Nyt kvantecomputerdesign til at forudsige molekyleegenskaberKredit:Leiden Institute of Physics Standardmetoden til at bygge en kvantecomputer med majoranas som byggesten er at konvertere dem til qubits. Imidlertid, en lovende anvendelse af kvanteberegning -
 Temperatur, fugtighed, vind forudsiger anden pandemibølgeOverførselshastigheden af coronavirus varierer på den nordlige og sydlige halvkugle afhængigt af årstiden, peger på en vejrafhængighed. Kredit:Talib Dbouk og Dimitris Drikakis, Universitetet i Nicos
Temperatur, fugtighed, vind forudsiger anden pandemibølgeOverførselshastigheden af coronavirus varierer på den nordlige og sydlige halvkugle afhængigt af årstiden, peger på en vejrafhængighed. Kredit:Talib Dbouk og Dimitris Drikakis, Universitetet i Nicos -
 Simuleringer forklarer detonationsegenskaber i TATBAll-atom-modellering afslører, at TATB-sprængstoffer danner stærkt reaktive forskydningsbånd af uordnet materiale, når de er chokeret over detonationsforhold, peger på en tidligere ikke registreret tæ
Simuleringer forklarer detonationsegenskaber i TATBAll-atom-modellering afslører, at TATB-sprængstoffer danner stærkt reaktive forskydningsbånd af uordnet materiale, når de er chokeret over detonationsforhold, peger på en tidligere ikke registreret tæ -
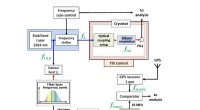 Kryogene testprober Einsteins ækvivalensprincip, generel relativitetsteori, og rumtiden skumIllustration af den eksperimentelle opsætning, hvor forskere forsøgte at opdage enhver ændring i længden af en kryogen siliciumresonator. De opdagede ingen ændring, til støtte for ækvivalensprincipp
Kryogene testprober Einsteins ækvivalensprincip, generel relativitetsteori, og rumtiden skumIllustration af den eksperimentelle opsætning, hvor forskere forsøgte at opdage enhver ændring i længden af en kryogen siliciumresonator. De opdagede ingen ændring, til støtte for ækvivalensprincipp
- Hvordan dyb læring styrker cellebilledanalyse
- Ledningsevne ved kanterne af grafen-dobbeltlag
- Er den rigtige formel for calciumoxid CaO?
- Soild -natriumchlorid kaldes et ionisk fast stof. Dens forudsagte egenskaber er hvad?
- Modellen afslører den bedste tilgang til at få folk til at spare på vandet i forskellige områder
- Hvor mange miles er troposfæren fra jorden?


