Hvad udøves kraften med en gas på sin beholder?
Her er en sammenbrud:
* gasmolekyler er i konstant tilfældig bevægelse: De bevæger sig i alle retninger med forskellige hastigheder.
* Kollisioner med væggene: Når et gasmolekyle kolliderer med beholdervæggen, udøver den en kraft på væggen.
* sum af kræfter: Kraften, der udøves af gassen på beholderen, er summen af alle kræfter fra individuelle kollisioner af gasmolekyler med væggene.
* tryk: Denne kraft fordelt over containerens overfladeareal er det, vi kalder tryk.
faktorer, der påvirker kraften:
* antal molekyler: Flere molekyler betyder flere kollisioner og derfor højere tryk.
* Temperatur: Højere temperatur betyder hurtigere molekyler, hvilket fører til mere kraftfulde kollisioner og højere tryk.
* bind: Mindre volumen betyder flere kollisioner med væggene pr. Enhedstid, hvilket fører til højere tryk.
Nøgle ligning:
Trykket af en gas er direkte proportionalt med den kraft, der udøves af gassen på dens beholder, og omvendt proportional med beholderens område. Dette forhold kan udtrykkes ved følgende ligning:
tryk (p) =kraft (f) / område (a)
Kortfattet: Kraften, der udøves af en gas på dens beholder, er et direkte resultat af de kontinuerlige, tilfældige kollisioner af gasmolekyler med beholdervæggene. Denne styrke er det, vi opfatter som pres.
 Varme artikler
Varme artikler
-
 Rekordhøj effektivitet til sikker lagring af kvantehukommelseKvantehukommelse til flyvende optiske qubits er en vigtig faktor for en lang række applikationer inden for kvanteinformation. Ved hjælp af et meget langstrakt ensemble af ultrakølede atomer, forskere
Rekordhøj effektivitet til sikker lagring af kvantehukommelseKvantehukommelse til flyvende optiske qubits er en vigtig faktor for en lang række applikationer inden for kvanteinformation. Ved hjælp af et meget langstrakt ensemble af ultrakølede atomer, forskere -
 Nulindeksmetamaterialer giver ny indsigt i grundlaget for kvantemekanikEn illustration af et metamateriale med næsten nul indeks viser, at når lyset bevæger sig igennem, bevæger det sig i en konstant fase. Kredit:Second Bay Studios/Harvard SEAS I fysik, som i livet, e
Nulindeksmetamaterialer giver ny indsigt i grundlaget for kvantemekanikEn illustration af et metamateriale med næsten nul indeks viser, at når lyset bevæger sig igennem, bevæger det sig i en konstant fase. Kredit:Second Bay Studios/Harvard SEAS I fysik, som i livet, e -
 Anstrengte materialer gør køligere superledereVed hjælp af avancerede beregningsmodeller, Dane Morgan og Ryan Jacobs afslørede ny indsigt i, hvordan belastning ændrer egenskaberne af superledende materialer. Ingeniører fra University of Wisco
Anstrengte materialer gør køligere superledereVed hjælp af avancerede beregningsmodeller, Dane Morgan og Ryan Jacobs afslørede ny indsigt i, hvordan belastning ændrer egenskaberne af superledende materialer. Ingeniører fra University of Wisco -
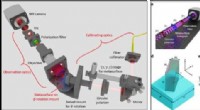 Dielektriske metaoverflader til næste generations hologrammerVENSTRE:Skematisk optisk opsætning til optisk rekonstruktion af holografiske scener i forskellige observationsvinkler. Bursystemets dele er udeladt for skematisk klarhed, men tjener til at holde den k
Dielektriske metaoverflader til næste generations hologrammerVENSTRE:Skematisk optisk opsætning til optisk rekonstruktion af holografiske scener i forskellige observationsvinkler. Bursystemets dele er udeladt for skematisk klarhed, men tjener til at holde den k
- Hvordan adskiller nuklear fusion sig grundlæggende fra fission?
- Hvad gør planter elektrisk excitable
- Kapaciteten til at arbejde eller producere lys er?
- Hvad er forskellen mellem moderne og gamle mircroscopes?
- Fra granatæbleskal til nanopartikler
- Hvad er forskellen mellem stalaktitter og stalagmitter?


