Hvordan er partikelbevægelse relateret til stof?
Stater for stof og partikelbevægelse:
* fast: Partikler er tæt pakket og vibrerer i faste positioner. Dette er grunden til, at faste stoffer har en defineret form og volumen.
* væske: Partikler er tættere end i en gas, men kan bevæge sig rundt, hvilket giver væsker et defineret volumen, men ikke en defineret form.
* gas: Partikler er langt fra hinanden og bevæger sig frit, hvilket giver gasser ingen defineret form eller volumen.
Temperatur og partikelbevægelse:
* AS Temperaturen øges , partikler får kinetisk energi og bevæger sig hurtigere. Denne øgede bevægelse fører til:
* udvidelse: Materialet udvides, når partikler bevæger sig længere fra hinanden.
* statsændringer: Opvarmning kan få et fast stof til at smelte ind i en væske eller en væske til at fordampe til en gas.
* AS temperaturen falder , partikler mister kinetisk energi og bevæger sig langsommere. Denne nedsatte bevægelse fører til:
* sammentrækning: Materiale kontrakter, når partikler bevæger sig tættere sammen.
* statsændringer: Afkøling kan få en gas til at kondensere til en væske eller en væske til at fryse til et fast stof.
Partikelbevægelse og egenskaber:
* densitet: Tætheden af et stof påvirkes af, hvor tæt pakket dens partikler er.
* diffusion: Bevægelsen af partikler fra et højt koncentrationsområde til et lavt koncentrationsområde. Dette forklarer, hvordan lugt spreder sig, eller hvordan sukker opløses i vand.
* tryk: I en gas er trykket et resultat af partikler, der kolliderer med væggene i deres beholder.
* Viskositet: Modstanden mod strømning i en væske påvirkes af interaktionen mellem dens partikler.
Konklusion:
Partikelbevægelse er ikke blot et teoretisk koncept, men et reelt fænomen, der forklarer mange egenskaber ved stof, herunder dens tilstand, opførsel og interaktion med dets omgivelser.
Sidste artikelHvad er kraften, når to ting slibes, passerer hinanden?
Næste artikelHvad er anvendelsen af fysik i luftfart?
 Varme artikler
Varme artikler
-
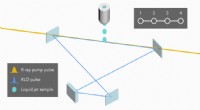 Looping røntgenstråler for at producere laserimpulser af højere kvalitetSkematisk arrangement af eksperimentet. Forskerne sender en røntgenpuls fra LCLS gennem en væskestråle, hvor det skaber exciterede atomer, der udsender en puls af stråling i en bestemt farve, der bevæ
Looping røntgenstråler for at producere laserimpulser af højere kvalitetSkematisk arrangement af eksperimentet. Forskerne sender en røntgenpuls fra LCLS gennem en væskestråle, hvor det skaber exciterede atomer, der udsender en puls af stråling i en bestemt farve, der bevæ -
 Neutronlevetidsmålinger tager ny form til in situ detektionIndiana University bachelorstuderende, Bailey Slaughter, sidder inde i Halbach magnetiske array-fælden. Hun verificerede både gravitationsindfangningen og magnetfelterne til neutronindeslutning. Kredi
Neutronlevetidsmålinger tager ny form til in situ detektionIndiana University bachelorstuderende, Bailey Slaughter, sidder inde i Halbach magnetiske array-fælden. Hun verificerede både gravitationsindfangningen og magnetfelterne til neutronindeslutning. Kredi -
 Kunstig mave afslører væskedynamik i madfordøjelsenIllustrationen viser flowfeltet og dråbeopdelingen omkring antralkontraktionsbølger. Kredit:Damien Dufour I bestræbelserne på at bekæmpe fedme og øge lægemiddelabsorptionen, forskere har grundigt
Kunstig mave afslører væskedynamik i madfordøjelsenIllustrationen viser flowfeltet og dråbeopdelingen omkring antralkontraktionsbølger. Kredit:Damien Dufour I bestræbelserne på at bekæmpe fedme og øge lægemiddelabsorptionen, forskere har grundigt -
 To-tonet lysmønster skaber stejle kvantevægge til atomerEn ny metode gør det muligt for forskere at fange atomer mellem stejle vægge. Kredit:N.Beier/JQI Eksotisk fysik kan opstå, når kvantepartikler samles og taler med hinanden. At forstå sådanne proce
To-tonet lysmønster skaber stejle kvantevægge til atomerEn ny metode gør det muligt for forskere at fange atomer mellem stejle vægge. Kredit:N.Beier/JQI Eksotisk fysik kan opstå, når kvantepartikler samles og taler med hinanden. At forstå sådanne proce
- Hvad er fluxer og fluxende midler i analytisk kemi?
- Internet -tv og mobilvideovisning truer med at få energibehovet til at stige
- Ved hjælp af fasediagrammet for H2O, hvilket af følgende beskriver korrekt vand ved 0°C og 1 atm?…
- Forskere udvikler den første selvkølende laser fremstillet med en silicafiber
- Selvødelagt redox-følsom stomatocyt nanomotor leverer og frigiver lægemidler til celler
- Hvordan beregner jeg en test Som 20% af en karakter?


