Hvad er den gennemsnitlige hastighed for partikelbevægelsesstoffer med en stor mængde termisk energi?
* Partikelbevægelse er tilfældig: Partikler i et stof bevæger sig ikke alle med samme hastighed. De har en fordeling af hastigheder, hvor nogle bevæger sig meget hurtigt, nogle bevæger sig langsomt og de fleste et eller andet sted imellem.
* Temperatur er gennemsnitlig kinetisk energi: Termisk energi er relateret til partiklernes gennemsnitlige kinetiske energi. Et stof med en masse termisk energi har partikler med en højere gennemsnitlig kinetisk energi, hvilket betyder, at de i gennemsnit bevæger sig hurtigere.
* Typer af stoffer betyder noget: Den gennemsnitlige hastighed for partikler afhænger af stoffens type. Gasser har meget højere gennemsnitshastigheder end væsker eller faste stoffer ved den samme temperatur, fordi partiklerne i en gas er meget mindre tæt bundet sammen.
I stedet for en enkelt hastighed taler vi om:
* rod-middel-kvadrathastighed (V_RMS): Dette er et mål for den gennemsnitlige hastighed for partikler under hensyntagen til fordelingen af hastigheder. Formlen for V_RM'er afhænger af stoffens type og dets temperatur.
* Distribution af hastigheder: I stedet for en enkelt hastighed taler vi ofte om fordelingen af hastigheder af partikler i et stof. Dette er repræsenteret af en graf kaldet Maxwell-Boltzmann-distributionen.
for at opsummere:
* Højere termisk energi betyder højere gennemsnitlig partikelkinetisk energi, hvilket generelt fører til hurtigere gennemsnitlige hastigheder.
* Den specifikke gennemsnitshastighed afhænger af stoffens type og dets temperatur.
* Vi bruger normalt V_RMS til at udtrykke gennemsnitlig partikelhastighed og Maxwell-Boltzmann-distributionen til at beskrive rækkevidden af hastigheder.
 Varme artikler
Varme artikler
-
 Forberedelse til en mere kraftfuld partikelacceleratorCMS-detektoren gennemførte adskillige opgraderinger under en tre år lang nedlukning for at forberede den nuværende fysikkørsel på LHC. Yderligere opgraderinger, der er planlagt til installation under
Forberedelse til en mere kraftfuld partikelacceleratorCMS-detektoren gennemførte adskillige opgraderinger under en tre år lang nedlukning for at forberede den nuværende fysikkørsel på LHC. Yderligere opgraderinger, der er planlagt til installation under -
 Fysikere manipulerer Abrikosov-hvirvlerDe tilfældigt fordelte hvirvler i den superledende prøve (til venstre) er blevet flyttet til et mønster, der danner bogstaverne “AV”, som står for Abrikosov -hvirvler (til højre). Kredit:Moskva Instit
Fysikere manipulerer Abrikosov-hvirvlerDe tilfældigt fordelte hvirvler i den superledende prøve (til venstre) er blevet flyttet til et mønster, der danner bogstaverne “AV”, som står for Abrikosov -hvirvler (til højre). Kredit:Moskva Instit -
 Nuklear scanningsteknik vil bringe fordele til mineindustrienKredit:Australian Nuclear Science and Technology Organisation (ANSTO) Mineindustrien vil drage fordel af en ny australsk kapacitet, der bruger en nuklear scanningsteknik til at detektere tilstedev
Nuklear scanningsteknik vil bringe fordele til mineindustrienKredit:Australian Nuclear Science and Technology Organisation (ANSTO) Mineindustrien vil drage fordel af en ny australsk kapacitet, der bruger en nuklear scanningsteknik til at detektere tilstedev -
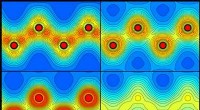 Mekanisme bag XFEL-induceret smeltning af diamant afsløretFigur 1:Plots der viser fordelingen af elektroner i diamant før (øverst til venstre) og 5 (øverst til højre), 20 (nederst til venstre) og 50 (nederst til højre) femtosekunder efter at være bestrålet
Mekanisme bag XFEL-induceret smeltning af diamant afsløretFigur 1:Plots der viser fordelingen af elektroner i diamant før (øverst til venstre) og 5 (øverst til højre), 20 (nederst til venstre) og 50 (nederst til højre) femtosekunder efter at være bestrålet
- Hvorfor guld-palladium-legeringer er bedre end palladium til brintlagring
- Hvad og hvor er biospere?
- Af jordbærgele og jordskælv:Rumstationsundersøgelse studerer kolloider
- Hvordan får planter og dyr vand i Arktis?
- Hvordan forholder computere sig til videnskab?
- Hvorfor vil tidevandet være anderledes om en milliard år?


