Sammenlign med en kold væske Hvordan ville partiklerne i varmt bevæge sig?
Koldvæske
* Slow Motion: Partikler i en kold væske bevæger sig langsomt. De har mindre kinetisk energi (bevægelsesenergi) og vibrerer mindre kraftigt.
* Luk sammen: På grund af lavere energi er partiklerne tættere sammen, hvilket resulterer i en tættere væske.
* mindre hyppige kollisioner: Partikler kolliderer sjældnere, fordi de bevæger sig langsommere.
varm væske
* hurtig bevægelse: Partikler i en varm væske bevæger sig hurtigt. De har mere kinetisk energi og vibrerer mere kraftigt.
* længere fra hinanden: Den øgede energi får partikler til at sprede sig, hvilket fører til en mindre tæt væske.
* hyppigere kollisioner: Partikler kolliderer oftere på grund af deres hurtigere hastigheder.
Analogi:
Forestil dig et overfyldt rum med folk, der står tæt sammen (kold væske). Alle bevæger sig langsomt, og de støder lejlighedsvis på hinanden. Forestil dig nu det samme rum, men folket er begejstrede og bevæger sig hurtigt (varm væske). De er spredt mere, og de støder på hinanden oftere.
Nøglepunkter:
* Temperatur er et mål for partiklernes gennemsnitlige kinetiske energi. Højere temperatur betyder højere kinetisk energi og hurtigere partikelbevægelse.
* stofstilstanden (fast, flydende, gas) påvirker også partikelbevægelse. I faste stoffer vibrerer partikler i faste positioner. I væsker kan partikler bevæge sig forbi hinanden. I gasser bevæger partikler sig frit og kolliderer ofte.
Fortæl mig, hvis du har andre spørgsmål!
 Varme artikler
Varme artikler
-
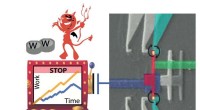 Realiseringen af en ny type informationsdæmon, der profiterer på gamblingstrategierKredit:Manzano et al. Forskere ved Det Internationale Center for Teoretisk Fysik (ICTP) i Italien og PICO-gruppen ved Aalto Universitet i Finland har introduceret ideen om en informationsdæmon, de
Realiseringen af en ny type informationsdæmon, der profiterer på gamblingstrategierKredit:Manzano et al. Forskere ved Det Internationale Center for Teoretisk Fysik (ICTP) i Italien og PICO-gruppen ved Aalto Universitet i Finland har introduceret ideen om en informationsdæmon, de -
 Forskere genererer fusion ved 100 millioner Kelvin i 20 sekunderTokamak-geometri og parameterudviklingen af en FIRE-tilstand. a, Plasmakonfigurationen af en FIRE-tilstand i KSTAR. Farven på linjerne angiver iontemperaturen i kiloelektronvolt, med 10 keV svaren
Forskere genererer fusion ved 100 millioner Kelvin i 20 sekunderTokamak-geometri og parameterudviklingen af en FIRE-tilstand. a, Plasmakonfigurationen af en FIRE-tilstand i KSTAR. Farven på linjerne angiver iontemperaturen i kiloelektronvolt, med 10 keV svaren -
 Samarbejde gør krystalklar undersøgelse af strålingsreaktionTo medlemmer af NA63-samarbejdet justerer en del af det setup, teamet brugte til at måle fænomenet strålingsreaktion. Kredit:NA63 -samarbejde Placer en ladet partikel i et elektromagnetisk felt, o
Samarbejde gør krystalklar undersøgelse af strålingsreaktionTo medlemmer af NA63-samarbejdet justerer en del af det setup, teamet brugte til at måle fænomenet strålingsreaktion. Kredit:NA63 -samarbejde Placer en ladet partikel i et elektromagnetisk felt, o -
 Kunstig intelligens løser Schrödingers ligningKredit:CC0 Public Domain Et team af forskere ved Freie Universität Berlin har udviklet en kunstig intelligens (AI) metode til at beregne grundtilstanden for Schrödinger-ligningen i kvantekemi. Mål
Kunstig intelligens løser Schrödingers ligningKredit:CC0 Public Domain Et team af forskere ved Freie Universität Berlin har udviklet en kunstig intelligens (AI) metode til at beregne grundtilstanden for Schrödinger-ligningen i kvantekemi. Mål
- Strækker sig til perfektion af 2-D halvledere
- Hvad er trætrinene jordhorisonter fra?
- Undersøgelse afslører dynamikken i overfladevandområder med 30 meter rumlig opløsning
- Microneedles teknik kan betyde hurtigere diagnoser af større sygdomme
- Ny supramolekylær plast, der er nedbrydelig og yderst genanvendelig
- højere, hurtigere, bedre, stærkere:Vindtårne bliver kun større


