Hvad fortæller kinetisk teori os om virkningen af temperatur på bevægelsespartikler?
* Højere temperatur =højere gennemsnitlig kinetisk energi: Når temperaturen på et stof øges, bevæger partiklerne inden i det hurtigere og har større gennemsnitlig kinetisk energi. Dette betyder, at de bevæger sig med større hastighed, vibrerer mere kraftigt og kolliderer med hinanden og containervæggene hyppigere og med mere kraft.
* lavere temperatur =lavere gennemsnitlig kinetisk energi: Omvendt, ved lavere temperaturer, bevæger partikler sig langsommere, har mindre gennemsnitlig kinetisk energi og kolliderer sjældnere.
Her er en mere detaljeret sammenbrud:
* kinetisk energi: Dette er den energi, der er besat af et objekt på grund af dets bevægelse. For partikler er kinetisk energi relateret til, hvor hurtigt de bevæger sig.
* gennemsnitlig kinetisk energi: Dette henviser til den gennemsnitlige kinetiske energi for alle partikler i et stof. Det er ikke det, at hver partikel bevæger sig med nøjagtigt samme hastighed, men den gennemsnitlige hastighed for alle partikler er relateret til temperatur.
* Direkte proportionalitet: Dette betyder, at når temperaturen stiger, øges den gennemsnitlige kinetiske energi for partiklerne også proportionalt. Forholdet er ikke lineært, men der er en klar og forudsigelig korrelation.
vigtige punkter at huske:
* Den kinetiske teori gælder primært for gasser , hvor partiklerne har mest bevægelsesfrihed. Det kan også påføres væsker og faste stoffer, men forholdet er mere komplekst på grund af kræfterne i tiltrækning mellem partikler.
* Temperatur er et mål for den gennemsnitlige kinetiske energi for partiklerne , ikke hastigheden på nogen individuel partikel.
* Den kinetiske teori hjælper med at forklare mange fænomener relateret til temperatur , såsom termisk ekspansion, varmeoverførsel og gassens opførsel.
Fortæl mig, hvis du gerne vil have flere detaljer eller specifikke eksempler!
 Varme artikler
Varme artikler
-
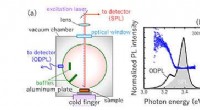 En ny metode til at måle optisk absorption i halvlederkrystaller(a) Et skema med temperaturvariabel ODPL -spektroskopi. Spektrene for ODPL og SPL samt r (ODPL-intensitet divideret med SPL-intensitet) målt ved (b) T =300 K og (c) T =12 K. Kredit:Kazunobu Kojima
En ny metode til at måle optisk absorption i halvlederkrystaller(a) Et skema med temperaturvariabel ODPL -spektroskopi. Spektrene for ODPL og SPL samt r (ODPL-intensitet divideret med SPL-intensitet) målt ved (b) T =300 K og (c) T =12 K. Kredit:Kazunobu Kojima -
 Traditionelle computere kan løse nogle kvanteproblemerKredit:CC0 Public Domain Der har været meget buzz om kvantecomputere og med god grund. De futuristiske computere er designet til at efterligne, hvad der sker i naturen i mikroskopiske skalaer, hvil
Traditionelle computere kan løse nogle kvanteproblemerKredit:CC0 Public Domain Der har været meget buzz om kvantecomputere og med god grund. De futuristiske computere er designet til at efterligne, hvad der sker i naturen i mikroskopiske skalaer, hvil -
 Fotoner kan aktivere fysisk tilfældig bitgenerering i realtid til informationssikkerhedsappUltrahurtige fysiske tilfældige bits kan genereres i realtid ved at kombinere bredbåndsfotoniske entropikilder med helt optiske signalbehandlingsteknikker. Kredit:Pu Li @TUT og GUT. Kryptografiske
Fotoner kan aktivere fysisk tilfældig bitgenerering i realtid til informationssikkerhedsappUltrahurtige fysiske tilfældige bits kan genereres i realtid ved at kombinere bredbåndsfotoniske entropikilder med helt optiske signalbehandlingsteknikker. Kredit:Pu Li @TUT og GUT. Kryptografiske -
 CERN lab på jagt efter mørkt stofLuftfoto af CERN. Kredit:CERN Europas fysiklaboratorium CERN sagde tirsdag, at det planlagde et nyt eksperiment for at lede efter partikler forbundet med mørkt stof, som menes at udgøre omkring 27
CERN lab på jagt efter mørkt stofLuftfoto af CERN. Kredit:CERN Europas fysiklaboratorium CERN sagde tirsdag, at det planlagde et nyt eksperiment for at lede efter partikler forbundet med mørkt stof, som menes at udgøre omkring 27
- Når skyen kollapser tyngdekraften tegner indad fordi?
- Hvordan har elektricitetscyklus gennem et hjem?
- En spand vand kan afsløre klimaændringernes indvirkning på livet i havet i Arktis
- Små brasilianske frøer er døve over for deres egne kald
- Kan en videnskabsmand observere alle stadierne sekundær succession på en forladt mark?
- Forskere indser fotodrevet nitrogenfiksering og ammoniaksyntese medieret af lithiumhydrid


