Hvilken tilstand af materie ville gennemgå den største volumenændring under en given temperatur, og hvorfor?
* gasmolekyler er langt fra hinanden: I modsætning til faste stoffer og væsker har gasmolekyler en masse tomme mellemrum mellem dem. Dette betyder, at de er meget mere komprimerbare.
* svage intermolekylære kræfter: De attraktive kræfter mellem gasmolekyler er meget svage. Dette giver dem mulighed for at bevæge sig frit og reagere let på ændringer i temperatur.
* kinetisk energi og volumen: Når temperaturen stiger, øges kinetisk energi af gasmolekyler. De bevæger sig hurtigere og kolliderer oftere, hvilket får dem til at udvide og besætte et større volumen.
I modsætning:
* faste stoffer: Molekyler i faste stoffer er tæt pakket og har stærke intermolekylære kræfter. De har meget lidt fri plads, så temperaturændringer har en minimal effekt på deres volumen.
* væsker: Væsker har mere plads mellem molekyler end faste stoffer, men oplever stadig stærkere intermolekylære kræfter end gasser. De er mindre komprimerbare end gasser, men mere komprimerbare end faste stoffer.
Kortfattet: Gasser er den mest komprimerbare stofstilstand på grund af deres løse molekylstruktur og svage intermolekylære kræfter. Dette gør dem meget følsomme over for temperaturændringer, hvilket resulterer i den største volumenændring.
Sidste artikelHvorfor er der ingen mekaniske bølger i OutSpace?
Næste artikelHvordan bærer du et forslag?
 Varme artikler
Varme artikler
-
 Forskere opdager en laghaleffekt i en 2D topologisk Axion antiferromagnetKredit:Unsplash/CC0 Public Domain Forskere har opdaget en lag Hall-effekt i en solid state-chip konstrueret af antiferromagnetisk mangan-vismuttellurid, et fund, der signalerer en meget efterspurg
Forskere opdager en laghaleffekt i en 2D topologisk Axion antiferromagnetKredit:Unsplash/CC0 Public Domain Forskere har opdaget en lag Hall-effekt i en solid state-chip konstrueret af antiferromagnetisk mangan-vismuttellurid, et fund, der signalerer en meget efterspurg -
 Ny opdagelse kan forbedre organiske solcelleydelseKredit:Lawrence Berkeley National Laboratory Mens der er et voksende marked for organiske solceller - de indeholder materialer, der er billigere, mere rigelig, og mere miljøvenlige end dem, der br
Ny opdagelse kan forbedre organiske solcelleydelseKredit:Lawrence Berkeley National Laboratory Mens der er et voksende marked for organiske solceller - de indeholder materialer, der er billigere, mere rigelig, og mere miljøvenlige end dem, der br -
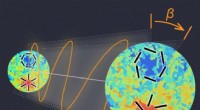 En antydning af ny fysik i polariseret stråling fra det tidlige universMens lyset fra den kosmiske mikrobølgebaggrund udsendt for 13,8 milliarder år siden (venstre billede) bevæger sig gennem universet, indtil det observeres på Jorden (højre billede), retningen, hvori de
En antydning af ny fysik i polariseret stråling fra det tidlige universMens lyset fra den kosmiske mikrobølgebaggrund udsendt for 13,8 milliarder år siden (venstre billede) bevæger sig gennem universet, indtil det observeres på Jorden (højre billede), retningen, hvori de -
 Forskere observerer dynamiske kvantefaseovergange i et interaktivt system med mange kroppeKredit:CC0 Public Domain Et team af forskere fra flere institutioner i Tyskland og Østrig har udviklet et middel til direkte at observere dynamiske kvantefaseovergange i et interagerende system me
Forskere observerer dynamiske kvantefaseovergange i et interaktivt system med mange kroppeKredit:CC0 Public Domain Et team af forskere fra flere institutioner i Tyskland og Østrig har udviklet et middel til direkte at observere dynamiske kvantefaseovergange i et interagerende system me
- Stresset ved at leve under vandet til at simulere kommende månemissioner
- Hvordan afbalancerer man den kemiske ligning HBr H2 plus Br2 N2O N2 O2 CH4 CO2 H2O?
- Hvordan diagram processen med spredning af havbunden?
- Lev længe og udhold:hvordan Kinas Mao blev bevaret
- Hvad er en simpel maskine, der ændrer den retning, som tvang udøvet?
- Hvorfor kan ikke en 3 -ion aluminium fremstilles ved at tilføje protoner til et atom?


