Enzymstrukturer belyser mekanismen bag bakteriers bioremedieringsevne
Bakterie, som mennesker og dyr, skal spise. Sommetider, de forbruger et forurenende stof i miljøet, som mennesker ønsker at slippe af med, en proces kaldet bioremediering. At undersøge de enzymer, der bruges af bakterier til at udføre denne proces, er vigtigt for forskerne at forstå og muligvis forbedre disse kraftfulde reaktioner. Imidlertid, indtil nu, at have et øjebliksbillede af et af disse vigtige enzymer i aktion har unddraget sig videnskaben.
I en publikation i tidsskriftet Natur udgivet i dag (27. marts, 2017), forskere fra Institut for Biokemi og Institut for Kemi ved University of Wisconsin-Madison har løst strukturen af et enzym, der er fanget i færd med at angribe toluen - et kemikalie, der stammer fra træ og olie.
"I denne forskning, vi forsøger at forstå, hvordan naturen bruger jernatomer, elektroner, og iltgas fra luften for selektivt at oxidere kemikalier, " siger biokemiprofessor og formand Brian Fox. "Denne reaktion er det første trin i en proces, hvor kulstofatomerne i toluen, kaldet en aromatisk ring, er forberedt til forbrug af bakterier."
Denne reaktion udspiller sig på atomniveau, i et spil med elektron- og atomoverførsel. Det aktive enzyms store sted indeholder to jernatomer, der også lagrer op til to elektroner. Disse reagerer med oxygengas for at kombinere og "angribe" den aromatiske ring af toluen, med elektroner, der udveksles undervejs. Ultimativt, et oxygenatom tilsættes toluenringen, åbner døren for andre reaktioner, som bakterierne bruger til at indtage toluen.
Den mest tilfredsstillende information afsløret af kombinationen af krystalstrukturer og kvantekemiske beregninger udført i denne undersøgelse, Fox siger, vedrører arten af det jern-ilt-mellemprodukt, der angriber den aromatiske ring. Forskere antog generelt, at det ville kræve en ekstremt reaktiv jern-oxygenart for at udføre denne reaktion. Men hvad Fox og hans team fandt var, at en mindre reaktiv form faktisk kunne bruges.
"De mest reaktive mellemprodukter, tidligere antaget at være en del af denne reaktion, ville også være uspecifik, " forklarer kemiprofessor Thomas Brunold. "Med det mellemliggende, der ville være en risiko for, at enzymet angriber, hvad der er i nærheden, inklusive sig selv. Hvis naturen kunne undgå dette ved at danne en mindre reaktiv, men stadig tilstrækkelig potent mellemprodukt, det kunne undgå mange uønskede bivirkninger. Det var, hvad Brian troede, der skete, og det var præcis, hvad han fandt."
Brunold tilføjer, at forståelsen af dette enzyms reaktion kan være nyttig for mange syntetiske kemikere. Mens de designer nye molekyler og veje, disse kemikere tager ofte hints fra en stor lærer – naturen selv. Kemikere har nu viden til bedre at efterligne den måde, dette enzym fungerer på, for at lave nye katalysatorer, der er mere specifikke til forskellige anvendelser.
Når bakterier udfører denne omdannelse af toluen, de starter en proces, der hurtigt fjerner det fra miljøet. På denne måde bakteriel bioremediering er i stand til at fjerne skadelige stoffer fra miljøet, noget videnskabsmænd allerede udnytter til at hjælpe økosystemer med at komme sig efter kemiske katastrofer som olieudslip. Andre forskere undersøger, hvordan man kan omdirigere reaktiviteten af dette enzym til at syntetisere nye kemikalier.
"Bredt, disse typer af naturlige reaktioner er miljøvenlige og billige, " siger Brunold. "I industrien, forskere udfører ofte udfordrende reaktioner med komplekse kemikalier under barske forhold, hvilket kan resultere i masser af spild og energiforbrug. Undersøgelse af hvordan enzymer som den, vi studerede, katalyserer deres reaktioner kan hjælpe med at finde mere effektive måder at udføre disse udfordrende reaktioner på. "
Til studiet, forskerne var i stand til at stoppe reaktionen midtvejs og danne et billede af præcis, hvordan enzymet fungerer. I en ganske vist mærkelig, men effektiv tilgang, forskerne tog en krystal af enzymet og dyppede det i toluen. De udsatte det så for luft, lader iltmolekyler begynde reaktionen. Endelig, de frøs krystallen, bremse reaktionen på præcis det rigtige tidspunkt for at fange mellemproduktet, før det kunne reagere yderligere.
"Det er virkelig vigtigt at kende denne struktur, "Fox siger." At have det giver os et unikt kig på, hvordan denne reaktion finder sted. Vi fandt noget uventet, og det giver nye veje til opdagelse og fremtidig anvendelse."
 Varme artikler
Varme artikler
-
 Molekylært tynd hybrid perovskit til avancerede optoelektroniske applikationerFigur 1:(a - e) Optisk billede af store 2D hybrid perovskitter (enkeltkrystal) og forskellige homologe serier (forbindelser med den samme funktionelle gruppe, men adskiller sig med antallet af gentagn
Molekylært tynd hybrid perovskit til avancerede optoelektroniske applikationerFigur 1:(a - e) Optisk billede af store 2D hybrid perovskitter (enkeltkrystal) og forskellige homologe serier (forbindelser med den samme funktionelle gruppe, men adskiller sig med antallet af gentagn -
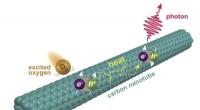 Kemikere får et kig på ny fluorescens i kulstofnanorørKemikere ved Rice University har opdaget et andet niveau af fluorescens i enkeltvæggede kulstofnanorør. Fluorescensen udløses, når oxygenmolekyler exciteret til en singlettilstand interagerer med nano
Kemikere får et kig på ny fluorescens i kulstofnanorørKemikere ved Rice University har opdaget et andet niveau af fluorescens i enkeltvæggede kulstofnanorør. Fluorescensen udløses, når oxygenmolekyler exciteret til en singlettilstand interagerer med nano -
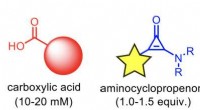 Lysinduceret modifikation af en carboxylsyre med en aminocyclopropenonFotoudløst modifikation af en carboxylsyre ved hjælp af en aminocyclopropenon. Reaktionen afsluttes på kort tid (5-10 min) selv ved lav koncentration (10-20 mM). Modifikationsreaktionen forløber i op
Lysinduceret modifikation af en carboxylsyre med en aminocyclopropenonFotoudløst modifikation af en carboxylsyre ved hjælp af en aminocyclopropenon. Reaktionen afsluttes på kort tid (5-10 min) selv ved lav koncentration (10-20 mM). Modifikationsreaktionen forløber i op -
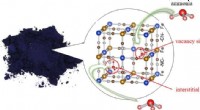 Et blåt pigment viste sig at være et højtydende ammoniakadsorbent(Figur):Preussisk blå (til venstre) og den preussiske blå krystalstruktur, der adsorberer ammoniakmolekyler (til højre). Kredit:Avanceret industriel videnskab og teknologi Akira Takahashi (forsker
Et blåt pigment viste sig at være et højtydende ammoniakadsorbent(Figur):Preussisk blå (til venstre) og den preussiske blå krystalstruktur, der adsorberer ammoniakmolekyler (til højre). Kredit:Avanceret industriel videnskab og teknologi Akira Takahashi (forsker
- Detektering af kraftige vinde drevet af et supermassivt sort hul fra La Palma
- Hvad er Facebook Watch og vil du kunne lide det?
- Forskere præsenterer et nyt syntetisk syn på Tibets topografiske udvikling
- Problemer, der stadig skal behandles for gennembrud Starshot -projektet
- Pile og smartphones:Amazon Tembe-stammens daglige liv
- Kinesiske astronomer undersøger røntgenudbrud af SGR J1935+2154


