Peanut-familiehemmeligheden for fremstilling af kemiske byggesten afsløret
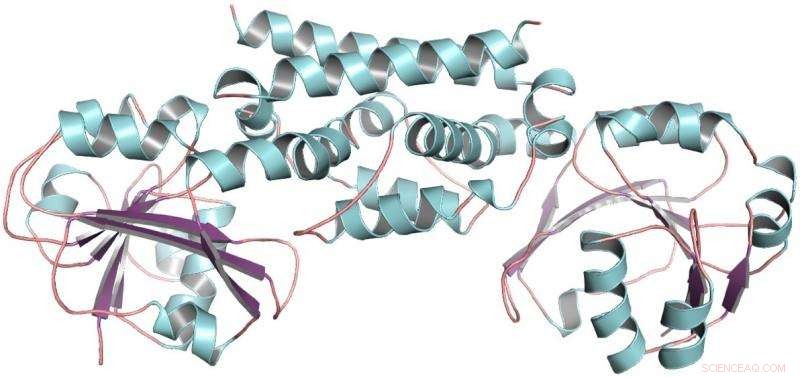
Den tredimensionelle struktur af PDH-enzymet fra sojabønne, en bælgplante. Denne struktur hjalp med at vise, at kun én mutation tillod bælgfrugter at udvikle en ny måde at fremstille aminosyren tyrosin på. Kredit:Craig Schenck
Mens du bider i din næste jordnøddesmør og gelésandwich, tyg på dette:Den jordnødde, du spiser, har en hemmelighed.
Det er en subtil en. Jordnødden og dens slægtninge - bælgfrugter - har ikke en, men to måder at fremstille aminosyren tyrosin på, en af de 20 nødvendige for at lave alle dens proteiner, og et væsentligt menneskeligt næringsstof. Det kan virke lille, men hvorfor denne plantefamilie har en unik måde at lave en så vigtig kemisk byggesten på er et mysterium, der strækker sig tilbage til 1960'erne og er en, der har fanget opmærksomheden hos Hiroshi Maeda, professor i botanik ved University of Wisconsin-Madison.
"Vi er interesserede i plantekemi, forsøger at forstå, hvordan planter laver så mange forskellige kemiske forbindelser, hvoraf mange er vigtige for vores menneskelige samfund som mad, fiber, foder, brændstof, medicin - så mange ting, " siger Maeda.
Disse vigtige molekyler starter fra simplere forbindelser, som tyrosin, som er forløberen for morfin og utallige andre interessante og nyttige kemikalier.
I ny forskning offentliggjort i 26. juni-udgaven af Naturens kemiske biologi , Maeda og hans kandidatstuderende Craig Schenck, sammen med samarbejdspartnere ved Washington University i St. Louis, rapporter om, hvordan bælgplantefamilien udviklede sin anden tyrosinvej. De opdagede strukturen af et nyt planteenzym, en, der kunne være et nyttigt værktøj for bioteknologer, der forsøger at kontrollere produktionen af tyrosin og dets derivater. Og de bandt en større evolutionær ændring i plantemetabolisme til en enkelt mutation i det nye enzym.
I 1960'erne og 70'erne, forskere undersøgte planteverdenen for at finde ud af, hvordan de lavede vigtige metaboliske forbindelser, som aminosyrer. Mens alle planter brugte én vej, kendt som ADH, at lave tyrosin, bælgplantefamilien - ærter, bønner, jordnødder – unikt tilføjet et sekund, kaldet PDH, som ellers kun fandtes i mikrober. Ingen vidste hvorfor og problemet blev sat til side.
Men for to år siden, Maeda og Schenck støvede det gamle mysterium af. Graver ind, de opdagede generne, der er ansvarlige for at lave tyrosin. De fandt ud af, at bælgplanterne havde udviklet deres PDH-enzymer fra eksisterende ADH-enzymer, lige før jordnødder og ærter udviklede sig til separate slægter. Søsterenzymerne var meget ens, hvilket betød, at kun et lille antal ændringer kunne forklare, hvordan ADH-enzymerne udviklede sig til PDH-enzymerne. Men der var stadig for mange ændringer til at teste én efter én for at se, hvilke der havde en effekt.
Så modtog Maeda et opkald fra Joe Jez, en biokemiker ved Washington University. Med Jez' elev Cynthia Holland, de to hold samarbejdede om at rense PDH-enzymet af sojabønne, en bælgfrugt, og bestemme dens tredimensionelle struktur. Med strukturen af PDH i hånden, Schenck kunne se det over evolutionær tid, kun et par mutationer var sket på det sted, hvor de kemiske reaktioner finder sted. I stedet for snesevis af mutationer at prøve, han havde kun to.
Schenck fandt ud af, at ved at ændre en enkelt aminosyre i midten af enzymet, han var i stand til i vid udstrækning at omdanne sojabønne-PDH-enzymet tilbage til dets forfader ADH-enzym. Skiftet fungerede for enzymer fra flere arter, og virkede omvendt:Schenck kunne give ADH-enzymer fra ikke-bælgplanter PDH-lignende egenskaber.
Maeda og Schenck havde opdaget, at bælgfrugter udviklede en ny måde at fremstille et vigtigt kemikalie på hovedsageligt ved at snuble over et enkelt, afgørende skifte.
"Det mest overraskende resultat er, at en enkelt rest virkelig spillede en stor rolle i skiftet til at fremstille dette bælgplantespecifikke enzym, " siger Maeda. "Og det rejser et interessant spørgsmål om, hvorfor andre grupper af planter aldrig udviklede dette unikke enzym. For bare med en tilfældig tilfældighed, måske fandt denne mutation sted, men blev aldrig opretholdt."
Lige hvorfor bælgfrugter holdt fast i deres nye tyrosinvej, og hvilken fordel det kan give, vil kræve mere arbejde.
Endnu en takeaway, siger Maeda, er, at den samme switch, der gør ADH-enzymer til PDH-enzymer, lukker for tyrosinets evne til at hæmme enzymets funktion. Selvom denne form for selvregulering normalt er nyttig for celler, Maeda mener, at PDH-ufølsomheden over for tyrosin kunne være en velsignelse for at hjælpe med at producere mere tyrosin, og dets nyttige derivater, i systemer som gær eller konstruerede anlæg.
"Tanken er den opiumsvalmue, for eksempel, fremstiller tyrosin gennem en standard ADH-vej, der sandsynligvis hæmmes af tyrosin, " forklarer Schenck, som for nylig afsluttede sin doktorgrad i Maedas laboratorium, drøfte mulige anvendelser til den nye forskning. "Hvis vi kan introducere et enzym, der ikke hæmmes af tyrosin, måske kan vi øge den samlede pulje af precursoren tyrosin for at øge morfinproduktionen. Det kan være et nyttigt værktøj fremover i andre plantearter eller endda i mikrober."
Sidste artikelSuper strækbar, superkomprimerbare superkondensatorer
Næste artikelUorganiske biomaterialer til vedhæftning af blødt væv
 Varme artikler
Varme artikler
-
 Hvad er en dehydratiseringsreaktion?En dehydratiseringsreaktion er en type kondensationsreaktion. Under processen med kombinationen af to forbindelser fjernes et vandmolekyle fra en af reaktanterne og danner en umættet forbindels
Hvad er en dehydratiseringsreaktion?En dehydratiseringsreaktion er en type kondensationsreaktion. Under processen med kombinationen af to forbindelser fjernes et vandmolekyle fra en af reaktanterne og danner en umættet forbindels -
 Screening for makrocykliske peptiderKredit:Ganga B. Vamisetti et al. Udviklingen af et fluorescens-baseret kompetitivt assay muliggjorde opdagelsen af dimeriske cykliske peptidmodulatorer af ubiquitinkæder, Angewandte Chemie Intern
Screening for makrocykliske peptiderKredit:Ganga B. Vamisetti et al. Udviklingen af et fluorescens-baseret kompetitivt assay muliggjorde opdagelsen af dimeriske cykliske peptidmodulatorer af ubiquitinkæder, Angewandte Chemie Intern -
 Forskere fremmer stamcelleterapi med biologisk nedbrydeligt stilladsEt biologisk nedbrydeligt uorganisk nano-stillads, bestående af stamceller, proteiner og lægemidler, til avanceret stamcelleterapi og lægemiddellevering. Kredit:KiBum Lee, Letao Yang og Sy-Tsong Dean
Forskere fremmer stamcelleterapi med biologisk nedbrydeligt stilladsEt biologisk nedbrydeligt uorganisk nano-stillads, bestående af stamceller, proteiner og lægemidler, til avanceret stamcelleterapi og lægemiddellevering. Kredit:KiBum Lee, Letao Yang og Sy-Tsong Dean -
 Syntese af potent antibiotikum følger en usædvanlig kemisk vejSyntesen af det potente antibiotikum thiostrepton bruger et radikalt SAM-protein TsrM, hvis krystalstruktur er vist til venstre, mens den er bundet til en jern-svovl-klynge og cobalamin. Nye billede
Syntese af potent antibiotikum følger en usædvanlig kemisk vejSyntesen af det potente antibiotikum thiostrepton bruger et radikalt SAM-protein TsrM, hvis krystalstruktur er vist til venstre, mens den er bundet til en jern-svovl-klynge og cobalamin. Nye billede
- COVID-19-pandemien motiverer fysiske forskere og ingeniører til at skabe globale løsninger
- Bestilte nanokrystal-arrays kan give en ny platform til at studere og skræddersy siliciums lysemitt…
- Isbro i argentinsk gletsjer kollapser, ingen vidner
- Kosmologer skaber rekordstor simulering af galaksedannelse
- Sådan læses en buekurve
- Dybe rev vil sandsynligvis ikke redde lavvandede koralrev


