Neutronundersøgelse af glaukomlægemidler giver fingerpeg om enzymmål for aggressive kræftformer
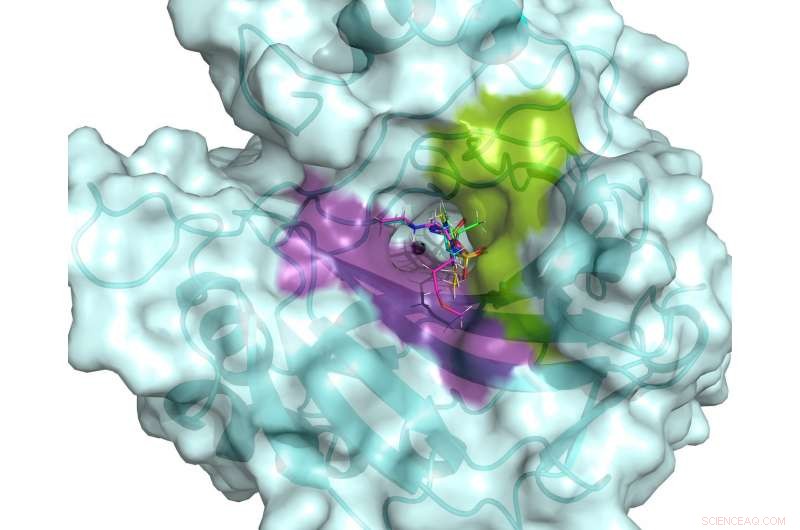
Det aktive sted for hCA II. Det aktive sted er flankeret af hydrofile (violette) og hydrofobe (grønne) bindingslommer, der kan bruges til at designe specifikke lægemidler rettet mod cancer-associerede hCA'er. Fem kliniske lægemidler er vist overlejret i det aktive hCA II-sted, baseret på stuetemperatur neutronstrukturer. Kredit:ORNL/Andrey Kovalevsky
Ny indsigt fra neutronanalyse af glaukomlægemidler og deres enzymmål kan hjælpe forskere med at designe lægemidler, der mere effektivt retter sig mod aggressive kræftformer.
Et team af forskere ledet af Department of Energy's Oak Ridge National Laboratory brugte neutron makromolekylær krystallografi til at undersøge de forskellige tilstande af tre glaukom-lægemidler, når de interagerer med det målrettede enzym, human kulsyreanhydrase II (hCA II).
"Vores mål var at observere forskelle i præsentationen af tre klinisk anvendte glaukomlægemidler, mens de er bundet til hCA II -enzymet, "sagde Andrey Kovalevsky, en instrumentforsker ved ORNL og en senior medforfatter af undersøgelsen. "Ved at se på, hvor godt disse lægemidler er målrettet mod hCA II i protonerede, neutrale og deprotonerede stater, vi håbede på at få indsigt, der ville gøre det muligt at forbedre disse lægemidler, så de bedre kan målrette enzymer, der er forbundet med kræft. "
Protonation refererer til tilstedeværelsen, tilføjelse eller tab af en proton, hvilket giver stoffet en neutral, positiv eller negativ ladning, henholdsvis. Ændring af et lægemiddels ladning kan ændre dets evne til at genkende og binde sig til dets målprotein og følgelig dens effektivitet.
Studiet, offentliggjort i tidsskriftet Struktur , fandt den temperatur, pH, og den elektriske ladning af de tre glaukom-lægemidler påvirkede deres evne til at målrette og binde med hCA II-enzymet.
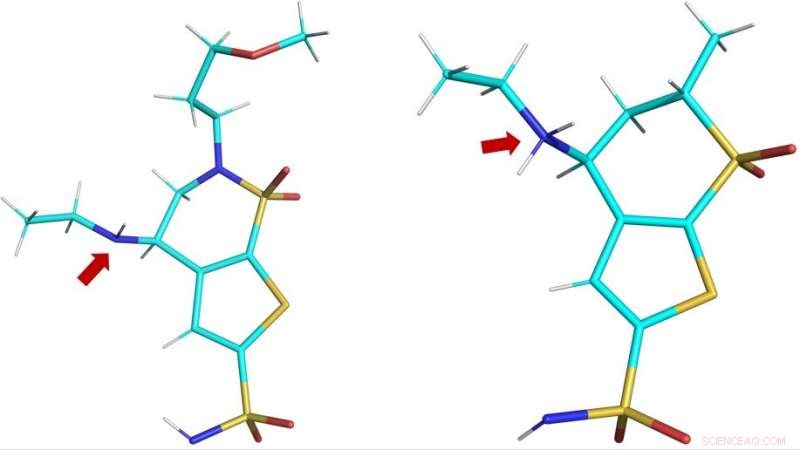
Tredimensionelle strukturer af de kliniske lægemidler brinzolamid (BZM, venstre) anddorzolamid (DZM, højre) som observeret i det aktive hCA II-sted. Den røde pil viser lægemidlernes aminogrupper:i BZM, nitrogenatomet (i blåt) er ikke protoneret og dermed ikke ladet; i DZM, nitrogenatomet har accepteret en ekstra proton og er dermed positivt ladet. Kredit:ORNL/Andrey Kovalevsky
"Denne opdagelse var virkelig et principbevis for os, " sagde Robert McKenna, en professor ved University of Florida og en senior medforfatter af undersøgelsen. "Det åbnede vores øjne for, hvordan ændringer i temperatur og pH kan påvirke protonationstilstanden af lægemidlet, hvilket igen gør det mere eller mindre effektivt."
Ny information om de hydrogenbindingsnetværk, der udgør det aktive sted for hCA II, kan hjælpe andre forskere med at udvikle nye og bedre lægemidler til kræftbehandling. Familien af hCA -enzymer indeholder lignende proteiner, såsom hCA IX og XII, der er forbundet med aggressiv brystkræft, såsom tredobbelt negativ brystkræft.
"Vi vil udnytte forskellen i ansvar, pH og temperatur for at se, om vi kan designe lægemidler, der er mere effektive til at målrette disse enzymer, "sagde Kovalevsky." Hvis vi kan forstå binding på atomniveau, vi kan redesigne medicin og gøre dem til stærkere og mere selektive 'magneter', der vil blive tiltrukket af kræftassocierede enzymer. Sådanne lægemidler ville være meget mere effektive til at dræbe kræftceller og efterlade sunde celler uskadt, hvilket reducerer bivirkninger betydeligt for patienter. "
Mange forskere har brugt røntgenkrystallografi til at analysere strukturer af hCA-enzymer, men disse undersøgelser mangler fuldstændig atominformation om lægemiddelbinding på grund af røntgenstråles manglende evne til at visualisere hydrogenatomer, der er rigelige i proteiner og enzymer.
Neutroner er følsomme over for lettere elementer, så de giver meget mere detaljerede oplysninger om placeringen af brintatomer. At se brint er afgørende for at studere protonationstilstande for et enzym og ligand-et molekyle, der binder sig til et biologisk makromolekyle-og for at analysere arkitekturen i hydrogenbindingsnetværk. Neutroner tilbyder også andre eksperimentelle fordele.
"Når du bruger neutrondiffraktion, har du ikke strålingsskader, så du kan lave dit studie ved stuetemperatur, sagde McKenna. frysning af krystaller kan ændre lægemidlet og enzymet, at introducere et falsk syn i undersøgelsen, mens stuetemperaturundersøgelser mere ligner det miljø, stoffet vil blive brugt i. "
 Varme artikler
Varme artikler
-
 Cellemembran inspirerer til ny ultratynd elektronisk filmSet ovenfra af 3D-computermodel (venstre) og Atomic Force Microscopy-billede (højre) af den nye film lavet af videnskabsmænd fra University of Tokyo. Molekylernes velorganiserede struktur er synlig i
Cellemembran inspirerer til ny ultratynd elektronisk filmSet ovenfra af 3D-computermodel (venstre) og Atomic Force Microscopy-billede (højre) af den nye film lavet af videnskabsmænd fra University of Tokyo. Molekylernes velorganiserede struktur er synlig i -
 Industriaffald genbruges til at producere alternativer til plastForskere ved São Paulo State University genbrugte bakteriecelluloseaffald, der normalt blev smidt af producenter af sårforbindinger for at lave stærk bionedbrydelig film til mademballage (rester tilba
Industriaffald genbruges til at producere alternativer til plastForskere ved São Paulo State University genbrugte bakteriecelluloseaffald, der normalt blev smidt af producenter af sårforbindinger for at lave stærk bionedbrydelig film til mademballage (rester tilba -
 N-dopede carbonindkapslede overgangsmetalkatalysatorer for at optimere ydeevnen af zink-luftbatter…Fe@NCG blev fremstillet ved pyrolysering af opløsningsmiddelfri dannede Fechitosan-chelater og yderligere nitrogen-urinstof med lille molekyle. Den dannede katalysator udviser bifunktionel katalytisk
N-dopede carbonindkapslede overgangsmetalkatalysatorer for at optimere ydeevnen af zink-luftbatter…Fe@NCG blev fremstillet ved pyrolysering af opløsningsmiddelfri dannede Fechitosan-chelater og yderligere nitrogen-urinstof med lille molekyle. Den dannede katalysator udviser bifunktionel katalytisk -
 Ny polymer fremstillingsproces sparer 10 størrelsesordener af energiUniversity of Illinois forskere Philippe Geubelle, venstre, Scott White, Nancy Sottos og Jeffrey Moore har udviklet en ny polymerhærdningsproces, der kan reducere mængden af tid og energi, der forbr
Ny polymer fremstillingsproces sparer 10 størrelsesordener af energiUniversity of Illinois forskere Philippe Geubelle, venstre, Scott White, Nancy Sottos og Jeffrey Moore har udviklet en ny polymerhærdningsproces, der kan reducere mængden af tid og energi, der forbr
- NASA ser på de tropiske cykloner Irwin og Hilarys nedbør og Fujiwara-effekten
- Hvad er de to processer, der producerer ATP?
- En vulkans puls kan bruges til at forudsige dens næste udbrud
- Beskeder fra verdens mindste rumsonde
- Indonesisk jordskælv og tsunami ødelægger kysten, mange ofre
- Løsning af mysteriet med Arctics grønne is


