Manipulerede enzymer – forskere sætter milepæl i biokatalyseforskning

Kathrin Heckenbichler og Rolf Breinbauer og deres team formåede for første gang nogensinde at 'genoplære' et enzym til at bygge ringformede molekylære strukturer i stedet for at udføre sin naturlige opgave med at reducere dobbeltbindinger. Kredit:© TU Graz
TU Graz-forskere formåede for første gang nogensinde at 'omskole' et enzym til at bygge ringformede molekylære strukturer i stedet for at udføre sin naturlige opgave med at reducere dobbeltbindinger. Værket blev udgivet i Angewandte Chemie , og er relevant for produktion af lægemidler og plantebeskyttelsesmidler.
Biokatalyse bruger enzymer til at fremkalde kemiske reaktioner. Denne form for 'blød kemi' erstatter i høj grad brugen af giftige reagenser eller opløsningsmidler i eksisterende synteser. Imidlertid, en stor udfordring i biokatalyse er at udvide dette koncept til helt nye kemiske reaktioner, der hidtil ikke er tilgængelige for enzymer, der findes i naturen. Et sådant nyt design blev skabt af et team af forskere ved TU Graz ledet af Rolf Breinbauer, leder af Institut for Organisk Kemi, og Kathrin Heckenbichler, som forfølger denne forskning inden for rammerne af en doktorafhandling ved Institut for Organisk Kemi. Breinbauer siger, "For første gang, vi har haft held med at manipulere et enzym til at udføre ikke dets naturlige funktion, men snarere en meget mere interessant funktion med hensyn til syntese. I stedet for at reducere dobbeltbindinger i en katalytisk proces, enzymet skaber nu molekylære strukturer i form af små ringe. Ved kun at udveksle én aminosyre i enzymets aktive center, vi har formået at undertrykke den naturlige reaktion og faciliteret et nyt reaktionsforløb."
Holdet ledet af Heckenbichler og Breinbauer var i stand til at producere 'cyclopropaner, ' ekstremt små ringformede molekyler i form af en trekant, ved hjælp af biokatalyse. Sådanne ringsystemer, også kaldet tre-ring systemer, forekommer ikke kun i mange biomolekyler, de er også et vigtigt strukturelt element i plantebeskyttelsesmidler og i lægemidler såsom p-piller, lægemidler, der bruges til at behandle astma- og AIDS-medicin. Værket er offentliggjort i det aktuelle nummer af Angewandte Chemie .
Molekylets gode og dårlige 'hånd'
Parallelt med dette, forskerne formåede også at mestre chiraliteten af det producerede molekyle, som har stor betydning ved fremstilling af medicin. Kiralitet, eller molekylers 'håndhævelse', beskriver, hvordan to molekyler af samme atom kan struktureres på en spejlvendt måde - enten højrehåndet eller venstrehåndet. En variant af disse enantiomerer kan være nyttig og den anden skadelig, og der lægges i dag stor vægt på kun at bruge den helbredende variant i produktionen af medicin. Dette sikrer, at medicin virker meget specifikt, og at der ikke opstår uønskede bivirkninger på grund af såkaldte chirale tvillinger. Kathrin Heckenbichler forklarer processen og resultatet af den biokatalytiske implementering af substratet:"For at muliggøre en optimal chiral genkendelse mellem enzym og substrat, vi designede et substrat med en stor rest. Ved at gøre dette, Vi kunne ideelt set udnytte de rumlige forhold i enzymets aktive center til at producere en cyclopropan i høj enantiomer renhed." Forskerne formåede kun at producere den ønskede enantiomer fra de to mulige chirale tre-ringede molekyler.
Forskerholdet fra TU Graz formåede at gennemføre en vigtig udvidelse af deres biokatalytiske repertoire for at åbne døren til forskellige applikationer, især i den "grønne" produktion af ny medicin og økonomisk produktion af generiske lægemidler, aromatiske stoffer og plantebeskyttelsesmidler. Formålet med denne såkaldte grønne kemi, som biokatalyse kan tilskrives, er at anvende milde og miljørigtige reagenser, indeholde miljøforurening, og spar energi og omkostninger.
Sidste artikelSer nærmere på elektrificerende kemi
Næste artikelEn ny slags vaccine baseret på edderkoppesilke
 Varme artikler
Varme artikler
-
 Videnskaben bag varierende ydeevne af forskellige farvede LED'erEn række flerfarvede LEDer, der periodisk er arrangeret for at afgive synligt lys; en kombination af InGaN baseret rød, blå, og grønne LEDer er afgørende for at dække belysningsbehov effektivt. Kredit
Videnskaben bag varierende ydeevne af forskellige farvede LED'erEn række flerfarvede LEDer, der periodisk er arrangeret for at afgive synligt lys; en kombination af InGaN baseret rød, blå, og grønne LEDer er afgørende for at dække belysningsbehov effektivt. Kredit -
 Sådan måles fusion Heat of Ice“Heat” repræsenterer molekylers termiske energi i et stof. Vand fryser ved 0 grader Celsius. Men temperaturen på en isterning kan falde godt under det. Når en isterning fjernes fra en fryser, stiger t
Sådan måles fusion Heat of Ice“Heat” repræsenterer molekylers termiske energi i et stof. Vand fryser ved 0 grader Celsius. Men temperaturen på en isterning kan falde godt under det. Når en isterning fjernes fra en fryser, stiger t -
 En klogere, sikrere måde at bekæmpe korrosion:Forskning viser, at ny korrosionsinhibitor er 10 gan…Testresultater, der viser områder på 1 mm (Intelli-ion) vs. 10 mm (kontrol) krybning i prøver. Kredit:Hexigone Ltd Uafhængig forskning har vist, at en sikrere, smartere korrosionsinhibitor kan bes
En klogere, sikrere måde at bekæmpe korrosion:Forskning viser, at ny korrosionsinhibitor er 10 gan…Testresultater, der viser områder på 1 mm (Intelli-ion) vs. 10 mm (kontrol) krybning i prøver. Kredit:Hexigone Ltd Uafhængig forskning har vist, at en sikrere, smartere korrosionsinhibitor kan bes -
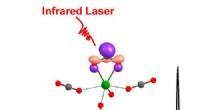 Forskere identificerer overgangsmetal til højeffektiv kuldioxidaktiveringSpektroskopisk identifikation af overgangsmetal M[η 2 -(O, O)C] arter til højeffektiv CO2-aktivering. Kredit:ZHENG Huijun Den atmosfæriske koncentration af kuldioxid (CO 2 ) har været stigende
Forskere identificerer overgangsmetal til højeffektiv kuldioxidaktiveringSpektroskopisk identifikation af overgangsmetal M[η 2 -(O, O)C] arter til højeffektiv CO2-aktivering. Kredit:ZHENG Huijun Den atmosfæriske koncentration af kuldioxid (CO 2 ) har været stigende
- Nye modeller til håndskriftsgenkendelse i online latinske og arabiske skrifter
- Hvilken slags fordøjelsessystem har squids?
- Ultramassive sorte huller opdaget i fjerntliggende galakser
- Rød, grøn, og blåt lys kan bruges til at kontrollere genekspression i manipuleret E. coli
- Hvad er Genotype for Roan Color?
- Kulstof doteret med nitrogen forbedrer lagringskapaciteten af superkondensatorer dramatisk


