Brug af en promiskuøs hæmmer til at afdække mål for kræftmedicin
Forskere ved Harvard Medical School og Dana-Farber Cancer Institute har udviklet en metode, der udnytter en kemisk hæmmers multitarget natur til at lokalisere sårbarheder i kræftceller.
Når signalveje i celler udløses, proteiner aktiveres gennem en kædereaktion, som en række af dominobrikker, indtil det endelige protein påvirker en eller anden cellulær funktion. I nogle tumorer, flere signalveje driver cellevækst og overlevelse. Denne redundans betyder, at hvis en vej stopper aktiviteten, en anden kunne fortsætte med at køre kræftadfærd. Dermed, medicin med evnen til at lukke flere veje på samme tid kan være en fordel.
Mange kræftmedicin, herunder nogle klinisk godkendte kinasehæmmere, blev oprindeligt designet til at blokere funktionen af specifikke molekyler, men det er nu kendt, at deres fordele måske ikke altid stammer fra hæmningen af enkelte mål.
"Mange af disse kovalente inhibitorer er faktisk i en vis grad polyfarmakologiske i deres virkning, og de kan målrette mod flere ting, " sagde Nathanael Gray, en professor i biologisk kemi og molekylær farmakologi ved Harvard Medical School og Dana Farber Cancer Institute i Boston, Massachusetts. "De er annonceret som arbejder gennem ét mål, men folk i feltet ved, at flere andre mål bidrager."
I en undersøgelse offentliggjort i Journal of Biological Chemistry , et team forskere ledet af Gray identificerede nøglemolekyler, der understøtter overlevelsen af en bestemt type lungekræftceller. Ved at analysere disse cellers respons på en kræftdræbende kinasehæmmer med adskillige mål, de var i stand til at vise, at anticancer-effekterne sandsynligvis blev fremkaldt af samtidig inhibering af specifikke molekyler i to signalveje. Denne tilgang til lægemiddelmålopdagelse kunne være nyttig til at designe lægemidler, der selektivt angriber flere proteiner, hvilket er gavnligt til at håndtere visse tumorer.
Selvom kinasehæmmere rammer flere mål, de fleste var ikke designet til at gøre det, hvilket betyder, at de kan binde sig til molekyler unødigt og føre til negative virkninger. Og fordi det har været uklart, hvilke kombinationer af mål der ville have de mest ønskværdige effekter, det har været udfordrende for forskere at målrettet designe multimålrettede lægemidler til kræft, sagde Gray.
For at muliggøre bedre lægemiddeldesign, Gray søgte at finde ud af, hvilken af de mange knapper, der trykkes på disse inhibitorer, der aktiverer deres anticancer-effekter. I en undersøgelse, der offentliggøres senere i år, Gray og hans laboratorium undersøgte kinaseinhibitoren SM1-71 og, ved hjælp af en række kemiske proteomiske og cellulære teknikker, viste, at det faktisk binder til snesevis af kinaser, hvoraf nogle er involveret i kritiske signalveje, der understøtter celleoverlevelse og vækst.
"Det var lidt som en dynamitstang og kunne virkelig ramme mange forskellige mål, " sagde Gray.
I undersøgelsen offentliggjort i JBC, forskerne udsatte forskellige typer kræftceller for SM1-71 og fandt ud af, at lægemidlet var meget giftigt for en specifik linje af lungekræftceller med muteret KRAS-protein, hvilket er almindeligt i nogle tumorer og fører til konstant aktivering af signalveje, der driver cellevækst. Hæmmerens evne til at dræbe disse celler på trods af denne mutation antydede, at mål i flere veje blev ramt, Sagde Gray.
For at finde ud af, hvilke hæmmende interaktioner, der bremsede kræftaktivitet, forskerne identificerede først, hvilke kinaser i deres tidligere genererede liste over SM1-71-mål, der var kendt for at være nøglesignalproteiner for cellevækst og overlevelse. De indsnævrede derefter disse kandidater med Western blotting, som viste, om nogen af disse proteiner fra kræftcellerne rent faktisk blev hæmmet, og så, at proteiner i to kritiske veje faktisk blev blokeret.
Forfatterne anvendte derefter forskellige kinasehæmmere, der blev brugt i forskning og klinikken for at se, om en specifik inhibering af en kombination af disse proteiner ville replikere de virkninger, som SM1-71 havde på kræftcellerne. Til sidst, inhibering af MEK1/2- og IGF1R/INSR-proteiner på samme tid viste lignende virkninger, tyder på, at disse er afgørende mål i denne lungekræftlinje, sagde Gray.
SM1-71 i sig selv ville sandsynligvis ikke være levedygtig hos mennesker, fordi den binder til for mange proteiner og kan føre til sideskader, sagde Gray. Men at afdække dets vigtigste mål inden for specifikke veje kunne hjælpe med design af fremtidige lægemidler, der kan lukke flere signalveje i tumorer.
"Det næste skridt ville være at forsøge at bevare effektivitetsdrivende mål og samtidig slippe af med mål, der kan bidrage til toksikologien, " sagde Gray.
 Varme artikler
Varme artikler
-
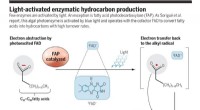 Et algenfotoenzym, der bruger blåt lys til at omdanne fedtsyrer til kulbrinterLysaktiveret enzymatisk kulbrinteproduktion. Kredit:(c) A. Kitterman / Videnskab , DOI:10.1126/science.aao4399 (Phys.org) - Et team af forskere tilknyttet flere institutioner i Frankrig har opda
Et algenfotoenzym, der bruger blåt lys til at omdanne fedtsyrer til kulbrinterLysaktiveret enzymatisk kulbrinteproduktion. Kredit:(c) A. Kitterman / Videnskab , DOI:10.1126/science.aao4399 (Phys.org) - Et team af forskere tilknyttet flere institutioner i Frankrig har opda -
 Forskere opfinder hurtigere, billigere strategi til design af infrarødt emitterende materialerKredit:Pixabay/CC0 Public Domain Northwestern University forskere har udviklet en ny lavpris, relativt enkel strategi til design af materialer, der bruges til billeddannelse med levende celler, fo
Forskere opfinder hurtigere, billigere strategi til design af infrarødt emitterende materialerKredit:Pixabay/CC0 Public Domain Northwestern University forskere har udviklet en ny lavpris, relativt enkel strategi til design af materialer, der bruges til billeddannelse med levende celler, fo -
 Brug af hvid eddike og isopropylalkoholHvid eddike eller eddikesyre og isopropylalkohol eller gnidning af alkohol er billig og praktisk til brug rundt omkring i huset. Begge kan bruges til rengøring, og de er også forholdsvis gode desinfek
Brug af hvid eddike og isopropylalkoholHvid eddike eller eddikesyre og isopropylalkohol eller gnidning af alkohol er billig og praktisk til brug rundt omkring i huset. Begge kan bruges til rengøring, og de er også forholdsvis gode desinfek -
 Grønt brint:Fokus på katalysatoroverfladenGrønt brint er et håb for energiomstillingen. Vellykket brug, imidlertid, kræver detaljeret forståelse af dets produktionsprocesser. Kredit:Pascal Armbruster, KIT Brug af energi fra solcellemodule
Grønt brint:Fokus på katalysatoroverfladenGrønt brint er et håb for energiomstillingen. Vellykket brug, imidlertid, kræver detaljeret forståelse af dets produktionsprocesser. Kredit:Pascal Armbruster, KIT Brug af energi fra solcellemodule
- Regnskoven indeholder spor, der kan hjælpe forskere med at diagnosticere Jordens ændrede vitale te…
- Beskyttelse af vådområder mod underjordiske påvirkninger af minedrift
- I det første, forskere måler præcist, hvordan syntetiske diamanter vokser
- Cyberangreb forårsager dyb skade på teknologirige skoler
- Beskriv overfladet terræn på Jupiter
- Klimaændringer kan ændre timingen af sommerens tordenvejr


