Sunde organeller, sunde celler

Nøglecellulære processer finder sted i dråber dannet af RNA-molekyler og fluorescensmærket protein. Kredit:Maria Hondele/ETH Zürich.
Det er for nylig blevet klart, hvor vigtige membranløse organeller er for celler. Nu har biokemikere ved ETH Zürich opdaget en ny mekanisme, der regulerer dannelsen af disse organeller. Dette har lagt grundlaget for mere målrettet forskning i sygdomme som Alzheimers eller ALS.
I lang tid, indholdet af celler blev anset for at være ret ustruktureret og kaotisk:en blanding af proteiner, DNA og et væld af små stofskiftemolekyler. Selvom vigtige cellulære processer i planter og dyr var kendt for at finde sted i organeller (større strukturer omsluttet af en membran, såsom kernen eller mitokondrier), det er først i de sidste par år, at videnskabsmænd har opdaget, at der er en anden type struktur, der spiller en afgørende rolle i organiseringen af cellulære processer:membranløse organeller. Disse små dråber dannes i en selvorganiseret proces, der ligner adskillelsen af oliedråber i vand.
I dag, der er megen evidens, der tyder på, at disse rum er af betydelig betydning for medicin:de kan være involveret i udviklingen af omkring 40 neurodegenerative sygdomme, herunder Alzheimers, Huntingtons sygdom og amyotrofisk lateral sklerose (ALS) - som alle i øjeblikket er uhelbredelige.
"Forskere opdager et stigende antal biologiske processer, der finder sted i disse organeller, adskilt fra resten af cellens indhold, siger Karsten Weis, Professor i biokemi ved ETH Zürich. Nu, sammen med sit team, han har forsket i princippet bag dannelsen af membranløse organeller og hvordan denne proces reguleres.
Proteiner der hænger sammen
For det, ETH-biokemikerne analyserede en specifik familie af proteiner kendt som DEAD-box ATPaser. I alle typer organismer - bakterier, planter og dyr – disse proteiner fungerer som en slags molekylær switch:når de først har bundet sig til energilagringsmolekylet adenosintrifosfat (ATP), de binder sig også til og transporterer RNA, skabelonen kopieret fra DNA til produktion af proteiner.
I hver organisme, nogle af disse DEAD-box ATPaser indeholder fleksible "arme", der kun består af en lille undergruppe af de i alt 20 aminosyrer. "Dette slående træk peger på en særlig funktion, " siger Weis. Til at begynde med, han og hans team undersøgte ATPaser fra gær. De modificerede de fleksible arme ved hjælp af genteknologiske metoder og analyserede derefter proteinerne både i reagensglasset og i levende gærceller. Ved at gøre det, de indså, at det netop er disse fleksible arme, der er ansvarlige for dannelsen og reguleringen af membranløse organeller.
"De fleksible områder er let opløselige i det vandige miljø inde i en celle, " forklarer Weis. "Men, når et stort antal ATPase-molekyler kommer sammen, disse fleksible dele får proteinerne til at binde sig til hinanden." ATPaserne kondenserer til store klynger, fører til en faseadskillelse svarende til olie i vand - og membranløse celleorganeller dannes. Yderligere eksperimenter med DEAD-box ATPaser fra humane og bakterielle celler indikerede for forskerne, at denne proces fungerer på en meget ens måde i alle typer organismer.
Organeller skaber orden
I øvrigt, ATPaserne sikrer ikke kun den selvorganiserede dannelse af organeller, men også bruge ATP-afhængig binding af RNA til at regulere transporten af RNA-molekyler og proteiner ind i disse strukturer, hvor RNA-molekylerne er opsamlet. Weis og hans kolleger mener, at det er muligt, at de er bearbejdet eller nedbrudt i strukturerne, eller blot gemt der i et stykke tid.
I levende celler, ETH-forskerne har endda observeret, hvordan RNA transporteres gennem flere forskellige membranløse organeller. "Dette tyder på, at yderligere behandling af RNA-molekylerne foregår trin for trin i forskellige organeller, " siger Weis. En organel er ansvarlig for et første trin i processen, den anden organel til den næste, og så videre - som at arbejde på en produktionslinje.
Mere målrettet forskning i fremtiden
Imidlertid, membranløse organeller er modtagelige for svigt. Over tid, de kan forvandle sig til hedengangne, klæbrige aggregater - til klumper, der ikke længere er flydende. "Det er denne form for permanente aggregater i cellerne, der forårsager neurodegenerative sygdomme, " siger Weis. Resultaterne fra hans forskergruppe tyder nu på, at DEAD-box ATPaser hjælper med at holde organellerne i en flydende tilstand - og derved forhindrer dannelsen af farlige aggregater.
Nu hvor biokemikerne har forstået, hvordan sådanne membranløse organeller reguleres, de er i stand til at studere fænomenet på en mere målrettet måde. For eksempel, ved at slå aktiviteten af ATPaserne til og fra, og de kan observere, hvordan dette påvirker organeller og celler. På denne måde ETH-forskerne vil i sidste ende finde ud af, hvilken rolle de membranløse rum spiller i sygdomsudviklingen.
 Varme artikler
Varme artikler
-
 All-solid-state lithium-svovl-batterier med høj kapacitet og lang levetidKredit:CC0 Public Domain Prof.Atsunori Matsuda, Prof. Hiroyuki Muto, Assistent Prof. Kazuhiro Hikima, Assistent Prof. Nguyen Huu Huy Phuc, Forsker Reiko Matsuda, og Takaki Maeda (kandidatuddannels
All-solid-state lithium-svovl-batterier med høj kapacitet og lang levetidKredit:CC0 Public Domain Prof.Atsunori Matsuda, Prof. Hiroyuki Muto, Assistent Prof. Kazuhiro Hikima, Assistent Prof. Nguyen Huu Huy Phuc, Forsker Reiko Matsuda, og Takaki Maeda (kandidatuddannels -
 Forskere undersøger materialeegenskaber for længerevarende, mere effektive solcellerTidligere postdoktor ved Florida State University, Sarah Wieghold, venstre, og FSU adjunkt i kemi og biokemi Lea Nienhaus. Deres forskning hjælper med at forstå de grundlæggende processer i et materia
Forskere undersøger materialeegenskaber for længerevarende, mere effektive solcellerTidligere postdoktor ved Florida State University, Sarah Wieghold, venstre, og FSU adjunkt i kemi og biokemi Lea Nienhaus. Deres forskning hjælper med at forstå de grundlæggende processer i et materia -
 Modifikationer af ikke-fulleren små molekyle acceptor i organisk tynd film til solceller forbedrer …Kredit:Australian Synchrotron Forskere fra Imperial College London, Monash University, CSIRO, og King Abdullah University of Science and Technology har rapporteret om en organisk tynd film til sol
Modifikationer af ikke-fulleren små molekyle acceptor i organisk tynd film til solceller forbedrer …Kredit:Australian Synchrotron Forskere fra Imperial College London, Monash University, CSIRO, og King Abdullah University of Science and Technology har rapporteret om en organisk tynd film til sol -
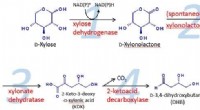 Metabolisk ingeniørmetode lykkes med at producere 1, 2, 4-butantetriol bæredygtigt fra biomasseFigur 1:Diagram over reaktionsprocessen. Kredit:Kobe University En mere miljøvenlig og bæredygtig metode til fremstilling af det nyttige kemikalie 1, 2, 4-butantetriol er blevet opdaget. Kobe -uni
Metabolisk ingeniørmetode lykkes med at producere 1, 2, 4-butantetriol bæredygtigt fra biomasseFigur 1:Diagram over reaktionsprocessen. Kredit:Kobe University En mere miljøvenlig og bæredygtig metode til fremstilling af det nyttige kemikalie 1, 2, 4-butantetriol er blevet opdaget. Kobe -uni
- Lenzs Law (Physics) Definition, ligning & eksempler
- Første test af solenergi-satellithardware i kredsløb
- Ny tilgang til super glat emballage har til formål at skære ned på madspild
- Silicabure hjælper anti-cancer-antistoffer med at dræbe tumorer i mus
- Ny bioinspireret lim binder enhver overflade under vandet
- Overfladeeffekt af elektroder afsløret ved operando overfladevidenskabelige metoder


