Protein kamæleon farver langtidshukommelsen
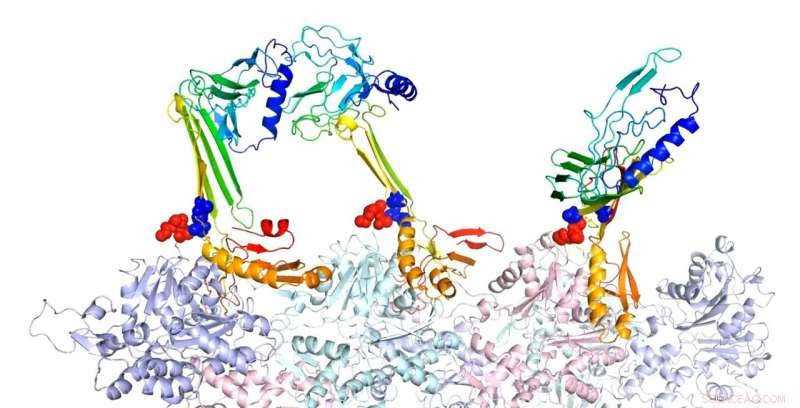
Forskere ved Rice University modellerede bindingsstrukturerne af actin og associerede proteiner, som de mener er ansvarlige for dannelsen af langtidshukommelse. Her, beta-hårnåleformen af lynlåssekvens er en potentiel kerne for dannelsen af intramolekylære beta-ark. I den forudsagte komplekse struktur af F-actin og tre PRD+ABD-konstruktioner vist ovenfor, de tre PDB+ABD-konstruktioner er vist i regnbuefarve, fra blå til rød, fra N-terminal til C-terminal. Overfladerne af de første 4 negative rester af actinmonomerer er farvet i rødt, og overfladerne af de to positive ender af lynlåssekvensen er farvet i blåt. Kredit:Center for Teoretisk Biologisk Fysik/Rice University
Et kamæleonlignende protein i neuroner kan ændre mening, og i processen ændre vores hjerner.
Forskere ved Rice University og University of Texas Health Science Center i Houston (UTHealth) afslørede nye spor i proteinet CPEB3 som en del af deres ihærdige stræben efter den mekanisme, der tillader mennesker at have langtidsminder.
Undersøgelsen af Rice teoretiske biofysiker Peter Wolynes og Neal Waxham, en neurobiolog ved UTHealth's McGovern Medical School, giver indsigt i en positiv feedback-løkke mellem dannelse af aktin-rygraden, der giver dendritiske rygsøjler deres form og fleksibilitet, og de aktin-bindende domæner i CPEB3, en funktionel prion, der binder RNA, som også danner langlivede aggregater, der faktisk kan lagre de ting, som minder er lavet af.
Proteinfoldningsmodeller af Wolynes og hans gruppe ved Rice's Center for Theoretical Biological Physics (CTBP) og eksperimenter ved UTHealth viste hidtil ukendte strukturelle detaljer for CPEB3 og hvordan det binder til actin, som rapporteret i Proceedings of the National Academy of Sciences papir.
I processen, de undersøgte også nøglerollen af et protein kendt som SUMO, en regulator, der binder til og løsnes fra andre proteiner i celler for at modificere deres funktioner. Forskerne formoder, at det hjælper med at regulere, hvornår og hvordan CPEB3s kamæleonlignende ender (N-terminalen og C-terminalen) binder til enten SUMO eller den fleksible, filamentøse actin (f-actin) rygsøjler i dendritiske pigge.
CPEB3-proteiner er opløselige, når de er knyttet til SUMO, som også begraver deres aktinbindingssteder. Men under synaptisk aktivitet, de kan "deSUMOyleres" og blive tilgængelige til at binde med de hydrofobe bindingslommer langs f-actin filamenter.
Modellerne viser, at når de tiltrækkes af aktin, CPEB3 går fra en oprullet spiral af spiraler til en beta-arkstruktur, der "zipper" ind i en hårnålekonfiguration, der gør det muligt for det at aggregere med andre CPEB3-proteiner.
Ved sammenlægning, CPEB3 ser ud til at oversætte sine målbudbringer-RNA'er, som omfatter actin mRNA, der styrker de synaptiske forbindelser, der er afgørende for hukommelsen, fuldende den positive løkke.
"Dette er et mere ambitiøst projekt end actin-CaM kinasestudiet, hvor vi også simulerede et virkelig enormt aktinsystem med et virkelig enormt protein, " sagde Wolynes. I den undersøgelse, udgivet for et år siden, CTBP-forskere modellerede, hvordan et centralt protein (CaMKII) holder parallelle actinfilamenter sammen, en tilstand, der kunne visualiseres i et elektronmikroskop af Waxhams laboratorium.
Nu definerer forskerne de strukturelle detaljer, der gør det muligt for CPEB3 at binde sig til enten actin eller SUMO, men ikke begge dele. "Et af hovedaspekterne af dette papir er at forene de to ret forskellige dele af historien, " sagde han. "Vi tror, at CPEB-terminalerne er kamæleonlignende, fordi de lader molekylet vælge, om det vil interagere med SUMO'en eller med aktinet.
"Vi er ikke til slutningen af historien endnu, " sagde Wolynes. "Men de seneste resultater sætter os et rimeligt sted at sige mere om mekanismen."
 Varme artikler
Varme artikler
-
 Forskere afslører dynamisk sølvkrystallisering ved in-situ SEMRadikale fluktuationer fører til sølv dynamisk krystallisation i et in-situ scanning elektronmikroskop. Kredit:HAN Yongsheng Forskellige strukturerede materialer har forskellige egenskaber og anve
Forskere afslører dynamisk sølvkrystallisering ved in-situ SEMRadikale fluktuationer fører til sølv dynamisk krystallisation i et in-situ scanning elektronmikroskop. Kredit:HAN Yongsheng Forskellige strukturerede materialer har forskellige egenskaber og anve -
 Video:Chemtrails vs. contrailsKredit:The American Chemical Society Det er let at se på det hvide spor bag et jetfly og forestille sig alle former for kemikalier, der regner ned ovenfra. Imidlertid, flyindstyr er simpelthen det
Video:Chemtrails vs. contrailsKredit:The American Chemical Society Det er let at se på det hvide spor bag et jetfly og forestille sig alle former for kemikalier, der regner ned ovenfra. Imidlertid, flyindstyr er simpelthen det -
 Radiofrekvensenergi opvarmer interessen for lavtemperatur nanokatalysatorerLouisiana State University-forskere brugte RF-felter til at opvarme jernoxidnanopartikler knyttet til oliemolekyler for at opnå mere energieffektive katalytiske reaktioner. Kredit:ORNL/Genevieve Marti
Radiofrekvensenergi opvarmer interessen for lavtemperatur nanokatalysatorerLouisiana State University-forskere brugte RF-felter til at opvarme jernoxidnanopartikler knyttet til oliemolekyler for at opnå mere energieffektive katalytiske reaktioner. Kredit:ORNL/Genevieve Marti -
 Omdannelse af svovldioxid fra skadelig til nyttigKredit:CC0 Public Domain Forskere har skabt molekylære bure i en polymer for at fange skadelig svovldioxidforurening for at omdanne den til nyttige forbindelser og reducere affald og emissioner.
Omdannelse af svovldioxid fra skadelig til nyttigKredit:CC0 Public Domain Forskere har skabt molekylære bure i en polymer for at fange skadelig svovldioxidforurening for at omdanne den til nyttige forbindelser og reducere affald og emissioner.
- Hvad tænker du på? Facebook siger, at nøgne statuer ikke burde være det
- Sådan kalibrerer du en kalorimeter
- Nyt materiale kunne gøre plastikfremstilling mere energieffektiv
- At finde grønne opløsningsmidler til trykt elektronik
- Hvordan kommer sædkernen i en pollenkorn til ægkernen i en plantugle?
- Deutsche Post graver dybt for at mestre pakkebom


